| Neues vom Helicobacter |
| Christa Kuderna Abteilung für Kinder- und Jugendheilkunde mit Infektionskrankheiten, Wilhelminenspital der Stadt Wien (Vorstand: Prim. Univ.-Prof. Dr. M. Götz) |
| Schlüsselwörter:
HP-Infektion im Kindes- und Jugendalter, Therapieindikation |
| Zusammenfassung Infektionen mit HP (Helicobacter pylori) gehören weltweit zu den häufigsten Erkrankungen. Jede HP-Infektion führt zur Ausbildung einer chronischen Gastritis. Ob es zu weiteren Folgeerkrankungen kommt, hängt von verschiedenen exogenen und endogenen Faktoren ab. In vielen Fällen bleibt die Erkrankung asymptomatisch, die Patienten sind beschwerdefrei. Da kein gesicherter Zusammenhang zwischen abdominellen Beschwerden und HP-Infektion besteht und europaweit ein deutlicher Anstieg der Resistenzrate gegen Antibiotika, die zur Eradikation herangezogen werden, beobachtet wird, sollte nicht unkritisch behandelt werden. Eine wesentliche Indikation zur Therapie ist die chronische Ulkuserkrankung auf dem Boden einer HP-Infektion, die durch erfolgreiche Eradikation geheilt werden kann. Da das Risiko einer malignen Erkrankung bei HP-Gastritis nicht signifikant höher ist als ohne Infektion und Magenkarzinom im Kindesalter praktisch nicht vorkommt, ist eine Therapie als Karzinomprophylaxe nicht gerechtfertigt. |
| Key-words: Infection with HP in childhood, eradication of HP in childhood |
| Summary Infections with HP (Helicobacter pylori) are one of the most prevalent diseases world wide. Each infection with HP leads to chronic gastritis. Exogene and endogene factors determine if this infection has further diseases as a consequence. In many cases patients remain asymptomatic. There is no proven causal relationship between abdominal symptoms and disease. All over Europe a trend of increasing resistance to antibiotics used in eradication therapy can be observed. Therefore uncritical use of antibiotic therapy is not recommended. An important indication for eradication is chronic ulcer disease caused by HP-infection which can be treated by eradication. The risk of malignant disease is not significantly different between HP-gastritis and gastritis not caused by HP. Since carcinoma of stomach in childhood are extremely rare, prophylactic antibiotic therapy seems not justified. |
Einleitung Ca. 10-15% aller Kinder und Jugendlichen leiden unter chronisch rezidivierenden Bauchschmerzen. Bei 58% der Patienten, die sich wegen ihrer Beschwerden einer Gastroskopie unterzogen, wurde die Diagnose Helicobacter pylori-(HP-)Gastritis gestellt. Die Erkenntnis, daß rezidivierende Oberbauchschmerzen häufig mit HP assoziiert werden konnten, war äußerst willkommen, da es den Anschein hatte, ein großes therapeutisches Problem gelöst zu haben. Dennoch zeigt sich jetzt in klinischen Nachuntersuchungen, daß bei Patienten mit rezidivierenden Bauchschmerzen und HP-Infektion manchmal trotz erfolgreicher Therapie die Beschwerden weiter bestehen oder aber nach mißglückter Eradikation die Symptome spontan sistieren. Gleichzeitig ergaben Studien in Deutschland, daß es keine spezifische Symptomatik gibt, die auf das Vorhandensein einer HP-Gastritis schließen läßt [6]. Zusätzlich ergibt sich das Problem der deutlichen Zunahme der Resistenzentwicklung bei Antibiotika, die für die Eradikation zur Verfügung stehen. Auf Grund dieser Erfahrungen stellt sich nun die Frage, ob die Eradikationsindikationen bei Infektionen mit HP nicht neu diskutiert werden sollten. |
| Mikrobiologische
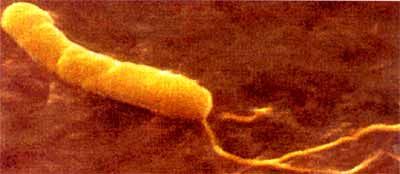
Eigenschaften Helicobacter pylori ist ein spiralförmiges, gramnegatives Bakterium mit glatter Oberfläche und mehreren Flagellen, die alle an einem Pol entspringen (Abb. 1).
Die Virulenz des Keimes hängt vor allem von einigen seiner mikrobiologischen Eigenschaften ab: - Motilität: Durch die 2-6 Flagellen wird eine
hohe Motilität erreicht, so daß die Keime mit raschen, schraubenförmigen Bewegungen
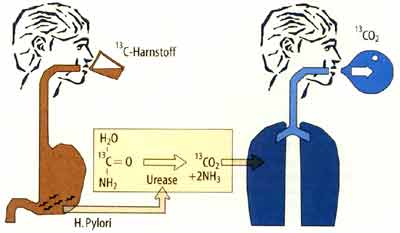
durch die Mucusschicht des Magens gleiten können. - Urease: Um sich vor dem sauren Milieu des Magenlumens zu schützen, produziert das Bakterium durch Spaltung von Harnstoff mit Hilfe des Enzyms Urease große Mengen an Ammoniak, die eine schützende Wolke um den Keim bilden, womit eine Infektion erst ermöglicht wird. - Phospholipidasen: Diese Enzyme greifen die Phospholipidschicht des Magenschleims an, um die Keimbesiedelung zu erleichtem. - Blockierung der Protonenpumpe: Im Rahmen der Erstinfektion kommt es durch Blockierung der Protonenpumpen vorübergehend zu einer Anazidität des Magens. - Zytotoxine: Durch Einwirkung von Zytotoxinen auf die Magenschleimhaut kommt es zu einer Schädigung der Mikrovilli und damit zu einer Schwellung der Epithelzelle und vermehrter Durchlässigkeit der Tight-junctions. Es gibt eine große genetische Variabilität bei HP, deren Virulenz bezüglich der Entstehung von Ulzera unterschiedlich ist. In diesem Zusammenhang wird besonders das cytotoxinassoziierte Gen A (cag-Gen) genannt, das durch vermehrte Produktion von proinflammatorischen Zytokinen wie IL-l, IL-8 und TNF-alpha eine stärkere Schädigung an der Magenschleimhaut verursacht [2]. Klinisch findet man bei Infektionen mit HP cagA positiv einen höheren Entzündungsgrad der chronischen Gastritis und häufiger Ulzera als bei HP cagA negativ [3]. |
| Epidemiologie Infektionen mit HP werden fast ausschließlich im Kindes- und Jugendalter erworben und bestehen ein Leben lang. Auf Grund serologischer Untersuchungen wird vermutet, daß der Altersgipfel der Erstinfektion um 5 Jahre liegt [4]. Etwa 50% der Gesamtbevölkerung ist mit HP infiziert, in Deutschland beträgt die Durchseuchungsrate etwa 4-5% [6], in Entwicklungsländern ist sie deutlich höher und wird mit bis zu 75% bei Kinder bis zum zehnten Lebensjahr angegeben [4]. Die genauen Ansteckungsmechanismen von HP sind noch nicht bekannt. Man vermutet neben der direkten Übertragung (oro-oral, gastro-oral, fäco-oral) auch indirekte Übertragungswege wie verseuchtes Wasser, Haustiere und mangelhaft desinfizierte Endoskope. Die Infektion findet sich gehäuft in Familien mit niedrigem sozioökonomischem Standard. Spontaneradikationen sind sehr selten, die Reinfektionsrate nach erfolgreicher Eradikation bei Kindern über 5 Jahre ist sehr gering. Das Zusammenleben mit HP-infizierten Eltern und Geschwistern bei niedrigem sozioökonomischem Standard ist kein Risikofaktor für Reinfektion [5]. |
| Klinische Manifestationen der HP-Infektion Die Erstinfektion mit HP ist von einer unspezifischen Gastroenteritis nicht zu unterscheiden. Nach einer Inkubationszeit von 5 Tagen treten Symptome wie Übelkeit und Erbrechen auf. Vorübergehend kommt es zum Anstieg des pH im Magenlumen auf 7, die Schleimhaut bleibt jedoch vorerst intakt. Nach einigen Tagen beginnt der Übergang in das chronische Stadium. Eine Infektion mit HP verursacht immer eine chronische Gastritis. Ob es nach Erstinfektion zum Auftreten einer chronisch aktiven Gastritis bzw. zur Ausbildung von Folgeerkrankungen wie Ulkuskrankheit, Magenkarzinom und MALT-Lymphom kommt, hängt in erster Linie von der Interaktion Wirt-Keim und von Einwirkung exogener Noxen ab (Tab. 1). Oft bleibt die Erkrankung auch lebenslang asymptomatisch und unerkannt.
Da das Karzinomrisiko bei HP-Gastritis um 0,1-3% erhöht ist, hat die WHO den Keim als Karzinogen der Klasse 1 klassifiziert. Peptische Ulzera entstehen bedeutend häufiger im Erwachsenenalter als bei Kindern und Jugendlichen [6]. Die Wahrscheinlichkeit, durch eine Infektion mit HP im Laufe des Lebens an einem Ulkus ventrikuli oder Ulkus duodeni zu erkranken, ist 15% höher als ohne HP-Infektion. Magenkarzinom kommt im Kindesalter praktisch nicht vor, und weltweit gibt es nur 10 veröffentlichte Fälle von Kindern mit MALT- Lymphom [7]. Daher spielt der zeitliche Ablauf für die Entwicklung von Folgeerkrankungen eine wichtige Rolle für das diagnostische und therapeutische Vorgehen (Tab. 2).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nachweismethoden einer HP-Infektion Keines der zahlreich zur Verfügung stehenden Testverfahren erfüllt den Goldstandard, mit dem alle sicher infizierten und alle sicher nicht infizierten Personen erfaßt werden (Sensitivität und Spezifität). Zur Diagnostik sollten daher immer mehrere Methoden verwendet werden. |
Endoskopie
|
Nicht
invasive Diagnostik
|
| Therapie Bisher hat sich in der Eradikation des HP die sogenannte französische Tripeltherapie, bestehend aus einer Kombination von Protonenpumpenhemmer, Amoxicillin und Clarithromycin durchgesetzt (Tab. 3).
|
| Indikationen
zur Therapie Vor Einleitung von diagnostischen Schritten muß in erster Linie eine genaue Anamnese durchgeführt werden. Oft ergibt sich aus den Ernährungsgewohnheiten mancher Kinder eine mögliche Ursache von immer wiederkehrenden Bauchschmerzen. Weiters ist es wichtig, die Häufigkeit und Intensität der Schmerzen zu beobachten und mit Hilfe eines Symptom-Tagebuches, in dem genaue Aufzeichnungen von Lokalisation, Dauer, Intensität und Häufigkeit gemacht werden, zu objektivieren. Die Lokalisation der Bauchschmerzen und deren Intensität können Hinweise auf Vorhandensein von Ulkus duodeni oder ventrikuli sein. Kinder, die an Ulkus leiden, haben signifikant stärkere Schmerzen als Kinder mit sogenannten funktionellen Bauchschmerzen. Die Schmerzen werden immer im Epigastrium lokalisiert [6]. Europaweit wird ein deutlicher Anstieg der Resistenzrate gegen Antibiotika, die zur Eradikation herangezogen werden, beobachtet. Das um 0,1-3% erhöhte Risiko für Magenkarzinom rechtfertigt keine Eradikation bei asymptomatischen Kindern und Jugendlichen, es sollte auch keine Therapie als Ulkusprophylaxe durchgeführt werden. Wenn allerdings bereits ein Ulkus vorhanden ist, führt die Eradikation von HP zu rascherem Abheilen der Läsionen und verhindert in bis zu 90% der Erkrankten die Ausbildung eines Rezidivulkus [8]. Deshalb sollte die Indikation zur Therapie streng gestellt werden. Da die einzige absolute Indikation zur Therapie im Kindes- und Jugendalter das Ulkus duodeni und Ulkus ventrikuli ist, wird empfohlen, zur Diagnosesicherung die Gastroskopie heranzuziehen (Tab. 4). Ob der alleinige Nachweis der aktuellen Infektion mittels 13C-Atemtest berechtigt, eine Eradikation einzuleiten, wird kontroversiell diskutiert.
|
| Literatur: 1. Wilson K., Fantry G.: "Pathogenesis of Helicobacter Pylori Infection." Current opinion in Gastroenterology 15 (1999) 66-71. 2. Luzza F., Contaldo A., Imeneo M., Mancuso M., Pensabene L., Giancotti L., La Vecchia A.M., Costa M.C., Strisciuglio P., Docimo C., Pallone F., Guandalini S.: "Testing for Serum Antibodies to Helicobacter Pylori Cytotoxin-associated Protein Detects Children with Higher Grades of Gastric Inflammation." J. Pediatr. Gastroenterol. Nutr. 29(3) Sept. (1999) 302-7. 3. Rowland M., Imrie C., Bourke B., Drumm B.: "How should Helicobacter infected children be managed." GUT 45 Suppl. 1 (1999) 136-39. 4. Roxland M., Kumar D., Daly L., O'Connor P., Vaughan D., Drumrn B.: "Low Rates of Helicobacter pylori Reinfection in Children." Gastroenterology 117 (2) Aug ( 1999). 5. Rowland M., Drumm B.: "Clinical Significance of Helicobacter Infection in Children." Br. med. bull. 54 (1998) 95-103. 6. Mondseer Gespräche 1999. 7. Dore M., Osato M., Kwon D., Graham D., EI-Zaatari F.: "Demonstration of Unexpected Antibiotika Resistance of Genotypically Identical Helicobacter Pylori Isolates." 8. Suzuki J., Mine T., Kobayasi I., Fujita T.: "Relationship Between the Eradiktion of Helicobacter Pylori and the Healing Pattern of Peptic Ulcer." J. Clin. Gastroenterol. 27. (1998) 159-162. |
| Anschrift des Verfassers: Dr. Christa Kuderna Abteilung für Kinder- und Jugendheilkunde mit Infektionskrankheiten, Wilhelminenspital A-1171 Wien, Montleartstraße 37 |