| Epidemiologie,
Klinik und Diagnostik von Bartonella-Infektionen |
| A. Sander
Institut für Medizinische Mikrobiologie und Hygiene der
Universität Freiburg
(Vorstand: Prof. Dr. med. C. Bogdan) |
Schlüsselwörter:
Bartonella, Carrión-Krankheit, Oroya-Fieber, Verruga peruana,
Katzenkratzkrankheit, Fünftagefieber, Bazilläre Angiomatose,
Peliose |
|
Zusammenfassung
Bartonella-Arten:
Die mit Bruzellen nahe verwandte Bartonellen sind kleine, pleomorphe,
gramnegative Stäbchenbakterien, welche auf bluthaltigen
Nährmedien angezüchtet werden können. In der
Reihenfolge der Erstbeschreibung sind heute folgende Bartonella-Arten
bekannt: B. bacilliformis, B. talpae, B. quintana, B. peromysci,
B. vinsonii spp. vinsonii, B. henselae, B. elizabethae, B. grahamii,
B. taylorii, B. doshiae, B. vinsonii spp. berkhoffii, B. clarridgeiae,
B. tribocorum, B. alsatica, B. koehlerae, B. vinsonii spp. arupensis,
B. birtlesii, B. schoenbuchii, B. bovis (= B. weissii), B. capreoli,
B. washoensis.
Reservoire:
Der Mensch gilt als Reservoir für B. bacilliformis
und B. quintana, Katzen für B. henselae,
B. clarridgeiae, B. koehlerae und B. weissii
(= B. bovis). Alle anderen Bartonella-Arten wurden
aus Blut von verschiedenen anderen Säugetieren isoliert.
Eine vertikale Übertragung von Bartonella-Arten wurde bei
einer bestimmten Mäuse- und Rattenart beobachtet. Kürzlich
wurde Bartonella-DNA in Zecken der Arten Ixodes
ricinus (Niederlande), Ixodes scapularis (USA)
sowie B. henselae-DNA in Ixodes ricinus (Italien)
nachgewiesen.
Krankheitserreger:
Acht der 19 bisher beschriebenen Bartonella-Arten gelten als
humanpathogen. B. bacilliformis kommt endemisch nur
in den südamerikanischen Anden vor (zweiphasige „Carrión-Krankheit“,
das „Oroya-Fieber“ und die „verruga peruana“).
Die weltweit häufigsten Infektionen werden durch B.
henselae (Katzenkratzkrankheit) und B. quintana
(Fünftagefieber oder Wolhynisches Fieber) hervorgerufen.
B. elizabethae, B. grahamii, B. vinsonii
spp. arupensis, B. vinsonii spp. berkhoffii und
B. washoensis wurden in Einzelfällen als Erreger
von Endokarditis oder Neuroretinitis beschrieben. B. clarridgeiae
wird als weiterer Erreger der Katzenkratzkrankheit diskutiert.
Bei immunsupprimierten Patienten sind bazilläre Angiomatose,
Bazilläre Peliosis hepatis, osteolytische Läsionen
und Fieber unklarer Genese die häufigsten Manifestationen
einer B. henselae- oder B. quintana-Infektion.
Bartonella-Endokarditiden durch B. henselae und B.
quintana werden in letzter Zeit immer häufiger überwiegend
bei alkoholabhängigen Patienten und Obdachlosen beobachtet.
Diagnose:
Antikörper gegen B. henselae mittels Immunfluoreszenztest;
IgG-Antikörper sind meist schon zum Zeitpunkt der Lymphknotenschwellung
nachweisbar, serologische Verlaufskontrollen erforderlich. Der
kulturelle Nachweis des Erregers aus Abstrichen, Lymphknoten
oder aus Blutkulturen ist sehr schwierig. Die PCR ist eine schnelle
und spezifische Nachweismethode für B. henselae.
Frisches oder tiefgefrorenes Material (Biopsien, Aspirate, Abstriche)
eignet sich am besten, während bei formalinfixiertem Gewebe
falsch negative Ergebnisse auftreten können. Bei Patienten
mit systemischen Symptomen kann auch eine PCR mit EDTA-Blut
zielführend sein.
Therapie:
Daten aus kontrollierten Studien fehlen fast vollständig.
Empfohlen werden für Carrión-Krankheit: Chloramphenicol,
Tetracycline, Erythromycin; Fünftagefieber: Makrolide,
Tetracycline; Katzenkratzkrankheit: Azithromycin, Doxycyclin,
Rifampicin; Bazilläre Angiomatose, Peliose: Makrolide oder
Doxycyclin, evtl. auch in Kombination mit Gentamicin oder Rifampicin.
|
Key-words:
Bartonella, Carrión’s disease, Oroya
fever, Verruga peruana, cat scratch disease, trench fever, bacillary
angiomatosis, peliosis |
|
Summary
Species:
Bartonella, closely related to brucella, are small, pleomorphic
gramnegative rods which can be grown on artificial medium supplemented
with blood. The following bartonella species are known today,
presented here in the order of first description: B. bacilliformis,
B. talpae, B. quintana, B. peromysci, B. vinsonii spp. vinsonii,
B. henselae, B. elizabethae, B. grahamii, B. taylorii, B. doshiae,
B. vinsonii spp. berkhoffii, B. clarridgeiae, B. tribocorum,
B. alsatica, B. koehlerae, B. vinsonii spp. arupensis, B. birtlesii,
B. schoenbuchii, B. bovis (= B. weissii), B. capreoli, B. washoensis.
Reservoirs:
Man is considered as reservoir for B. bacilliformis
and B. quintana, cats for B. henselae, B.
clarridgeiae, B. koehlerae and B. weissii
(= B. bovis). All other bartonella species were isolated
from the blood of various other mammals. Vertical transmission
of certain bartonella species was observed in distinct mouse
and rat species. Recently, bartonella DNA was demonstrated in
ticks of the species Ixodes ricinus (Netherlands) and
Ixodes scapularis (USA); additionally, B. henselae
DNA was detected in Ixodes ricinus (Italy).
Agents
of human disease: Eight of 19 hitherto known bartonella
species are considered human pathogens. B. bacilliformis
is endemic only in the South American Andes (biphasic „Carrión’s
disease“, „Oroya fever“ and „verruga
peruana“). The most frequent bartonella infections globally
are caused by B. henselae (cat scratch disease) and
B. quintana (trench fever or Wolhynien fever). B.
elizabethae, B. grahamii, B. vinsonii spp.
arupensis, B. vinsonii spp. berkhoffii and B.
washoensis were found as causative agents of endocarditis
or neuroretinitis in single cases. B. clarridgeiae
seems to be a further agent of cat scratch disease. Bacillary
angiomatosis, bacillary peliosis hepatis, osteolytic lesions
and fever of unknown origin are the most frequent manifestations
of a B. henselae or B. quintana infection
in immunocompromised patients. Bartonella endocarditis caused
by B. henselae and B. quintana is recently
reported with increasing frequency; it is predominantly seen
in patients who are addicted to alcohol and in homeless people.
Diagnosis:
Antibodies against B. henselae by immuno fluorescence
assay; IgG antibodies are usually detectable at the time of
lymph node swelling; control of the serological course is necessary.
Culture of bartonella from smears, lymph nodes or from blood
is too time consuming and too insensitive for routine diagnostic
purposes. PCR is a quick and specific tool for the detection
of B. henselae DNA. Fresh or deep frozen specimen such
as biopsies, aspirates, and smears are ideal, whilst formalin
treated tissue may yield in false negative results. PCR with
EDTA blood is recommended in patients with systemic symptoms.
Therapy:
Results from controlled clinical studies are almost completely
missing. The following antibiotics are recommended for Carrión’s
disease: chloramphenicol, tetracyclines, erythromycin; trench
fever: macrolides, tetracyclines; cat scratch disease: azithromycin,
doxycycline, rifampicin; bacillary angiomatosis, peliosis: macrolides
or doxycycline, alone or in combination with gentamicin or rifampicin. |
Einleitung - Historischer
Überblick
Peru und der Bau der Eisenbahnstrecke von Lima nach
La Oroya
Mehrere
Jahrzehnte lang bestand die Familie der Bartonellaceae
aus einer einzigen Spezies: Bartonella bacilliformis,
dem in den Flusstälern und Canyons der südamerikanischen
Anden endemisch vorkommenden Erreger der Carrión-Krankheit.
Die Bakterien werden durch Blut saugende weibliche Sandfliegen
der Gattung Lutzomya verrucarum übertragen, welche
in den Andentälern zwischen 500 und 3.000 m Höhe über
dem Meeresspiegel vorkommen [1]. Ausbrüche von Erkrankungen
durch diesen Erreger wurden besonders in Peru, aber auch in
Kolumbien und Ecuador beobachtet. Große Epidemien traten
immer dann auf, wenn größere Gruppen von Fremden
in diese endemischen Gebiete kamen. 1870, kurz nach der Gründung
der Republik Peru, beschloss die damalige Regierung, eine Eisenbahn
von der Hauptstadt Lima in das 5.000 m hoch gelegene Minengebiet
La Oroya bauen zu lassen. Zu diesem Zweck wurden über 10.000
Arbeiter aus Chile und den Küstenstädten Perus angeheuert,
aus Gebieten, in welchen die Carrión-Krankheit völlig
unbekannt war. Im Verlauf der Bauarbeiten, und hier besonders
während der Arbeiten entlang des Rimac-Flusses, erkrankten
und starben über 8.000 Menschen an hohem Fieber und schwerer
Anämie. Diejenigen, welche dieses akute Stadium, nach der
Zielstrecke La Oroya auch „Oroya-Fieber“ genannt,
überlebten, entwickelten Wochen bis Monate später
warzenartige Hautveränderungen, so genannte „verruga
peruana“. An diese Ereignisse erinnert noch heute die
„Puente de Verrugas“, ein Viadukt an dieser Strecke.
Man sagt, dass damals jede Schiene dieser Eisenbahnstrecke ein
Menschenleben gekostet hätte [2].
Im August
1885 wollte ein junger, 26-jähriger peruanischer Medizinstudent
namens Daniel Alcides Carrión in einem heroischen Selbstversuch
zeigen, dass das Oroya-Fieber und die Verruga peruana durch
ein und denselben Erreger hervorgerufen werden. Er beobachtete
9 Fälle von Verruga peruana und inokulierte sich Sekret
aus Hautläsionen eines 14-jährigen Patienten. 21 Tage
danach erkrankte er mit hohem Fieber und einer schweren Anämie,
woran er nach weiteren 18 Tagen am 5. Oktober 1885 verstarb
[2]. Ihm zu Ehren wird die lange Zeit als „Bartonellose“
bekannte Erkrankung auch „Carrión-Krankheit“
genannt.
Die wohl
älteste bekannte Epidemie datiert jedoch in das Jahr 1540
zurück, und ihr zweiphasiger Verlauf wurde von dem Conquistador
Miguel de Estete bereits detailliert beschrieben. Gleichzeitig
wies auch er schon darauf hin, dass die Erkrankung bei Fremden
sehr viel schwerwiegender verlief als bei der einheimischen
Bevölkerung [3]. Typische morphologische Veränderungen
einer Verruga peruana wurden kürzlich auch in einer rehydrierten
Mumie aus der Inka-Zeit nachgewiesen [4], ein Beweis dafür,
dass diese Erkrankung schon seit vielen Jahrhunderten in dieser
Region existiert.
Durch den
Versuch, die Sandfliegen in den endemischen Gebieten auszurotten,
sind diese in anderen Regionen vermehrt aufgetreten. Dadurch
sind in jüngster Zeit neue Epidemien in bis dahin endemiefreien
Gegenden bis 3.200 m aufgetreten [5, 6], die letzte erst 1998
in der Region Urubamba in Peru [7].
Fünftagefieber
und die beiden Weltkriege
Zu Beginn
des Jahres 1916 beschrieben die deutschen Truppenärzte
His und Werner unabhängig voneinander eine zyklisch verlaufende
fieberhafte Erkrankung, welche an der Ostfront des 1. Weltkrieges,
in Wolhynien, einem Gebiet in der heutigen Ukraine, unter den
deutschen Soldaten vorkam und nach Aussagen der wolhynischen
Ärzte in der Zivilbevölkerung völlig unbekannt
war [8]. Bereits im Juli 1916 trat die Erkrankung auch an anderen
Orten an der östlichen und westlichen Kriegsfront auf.
Mehr als 400.000 Soldaten erkrankten im Verlauf des Krieges
[9]. Typische Symptome waren allgemeines Krankheitsgefühl,
etwa alle 5 Tage auftretendes rezidivierendes Fieber bis 40°C,
Gewichtsverlust, Kopf-, Brust-, Rücken-, Gelenk-, Muskel-
und Knochenschmerzen, wobei besonders das Schienbein häufig
betroffen war. Je nach Zahl der Anfälle wurde eine mehr
oder weniger stark ausgeprägte Anämie beobachtet.
Leber- und Milzvergrößerungen traten eher selten
auf. Die Erkrankung wurde Fünftagefieber (Werner) bzw.
Wolhynisches Fieber (His) genannt, ist aber auch als Werner-His’sche-Krankheit
oder auch als Schützengrabenfieber bekannt [10]. In Selbstversuchen
haben Werner und Benzler [11] gezeigt, dass eine intramuskuläre
Injektion von Patientenblut nach einer Inkubationszeit von 20
bzw. 23 Tagen die typischen Krankheitssymptome des Fünftagefiebers
hervorruft, und damit die infektiöse Ätiologie der
Erkrankung bewiesen.
Therapeutisch
wurden damals Neosalvarsan, Arsen, Chinin, Optochin, Aspirin
und Pyramidon eingesetzt, jedoch mit mäßigem Erfolg
[8, 12]. Die Erkrankung galt als benigne mit einer sehr guten
Prognose. Todesfälle wurden nicht beobachtet. Die übliche
Krankheitsdauer betrug etwa 3 bis 4 Monate, und nach durchschnittlich
6 bis 10 Fieberschüben waren die Beschwerden von selbst
abgeklungen [12]. Rezidive wurden jedoch bei einzelnen Patienten
bis zu 11-19 Jahre nach Erstinfektion beobachtet.
Spätere
Nachforschungen ergaben, dass Berichte über Fünftagefieber
bereits seit dem Mittelalter bekannt waren [9]. In Nordirland
wurde in der zweiten Hälfte des 19. Jahrhunderts die gleiche
Krankheit beschrieben [13], und auch in Russland war die Erkrankung
nicht unbekannt [14]. Nach dem 1. Weltkrieg wurden Fälle
in Spanien, Schweden, der Ukraine, Georgien und Russland [9]
beobachtet, und während des 2. Weltkrieges haben deutsche
Truppen die Infektion nach Norwegen, Finnland und Jugoslawien
gebracht [15]. Danach wurden Erkrankungen in Algerien, Ägypten,
Äthiopien, Japan, China und Mexiko registriert [15]. Obwohl
das Fünftagefieber danach jahrzehntelang wieder in Vergessenheit
geriet, werden auch heute noch Epidemien durch diesen Erreger
beobachtet. Der jüngste Ausbruch wurde 1997 in Burundi
beschrieben [16].
Henry
da Rocha Lima, ein brasilianischer Mikrobiologe an der deutschen
Ostfront
Henry da
Rocha Lima wurde 1879 in Brasilien geboren, und nachdem er 1901
sein Medizinstudium beendet hatte, kam er zur fachlichen Weiterbildung
nach Deutschland. Nach 2-jährigem Aufenthalt am Hygieneinstitut
und am Pathologischen Institut Rudolf Virchow in Berlin kehrte
er wieder nach Brasilien zurück, wo er sich im Institut
von Oswaldo Cruz in Manguinhos besonders dem „symptomatischen
Karbunkel“, welches die brasilianischen Viehherden vernichtete,
und dem Gelbfieber widmete. 1907 fand in Berlin eine internationale
Hygieneausstellung statt, und unter 123 Ausstellern aus 20 verschiedenen
Ländern sprach das Komitee Brasilien den ersten Preis zu,
u.a. für die Arbeiten am Gelbfieber und an der Beulenpest.
Dies veranlasste auch deutsche Mikrobiologen, wie Prof. S. von
Prowazek und Prof. G. Giemsa, zu einem 6-monatigen Studienaufenthalt
nach Rio zu reisen. Im Gegenzug reisten brasilianische Fachgelehrte,
darunter auch da Rocha Lima nach Deutschland, wo er 1909 erst
in München, danach in Jena und schließlich von 1910
bis 1928 bei Prof. von Prowazek am Tropeninstitut in Hamburg
arbeitete. Sein Interesse galt dem Gelbfieber, der amerikanischen
Trypanosomiasis, der peruanischen Warze (Verruga peruana), Histoplasma
capsulatum u.a. Blastomykosen.
1914 beauftragte
ihn die Heeresgruppe IX, eine Flecktyphusepidemie in einem russischen
Gefangenenlager bei Cottbus aufzuklären. Zusammen mit von
Prowazek begann er mit neuen Untersuchungen über diese
Krankheit, an welcher sie beide kurz danach erkrankten. Professor
von Prowazek erlag ihr am 17. Februar 1915, während da
Rocha Lima, obwohl schwer mitgenommen, mit dem Leben davonkam.
Er setzte seine Forschungen über die Erkrankung fort, und
es gelang ihm, das „Virus“ der Erkrankung festzustellen.
Seine Ergebnisse stellte er auf dem Kongress für Kriegspathologie
vom 26. bis 27. April 1916 in Berlin vor. Zu Ehren der beiden
Gelehrten Ricketts und von Prowazek, die als Märtyrer der
Wissenschaft ihr Leben bei ihren Forschungen über das Fleckfieber
geopfert hatten, gab er dem Erreger den Namen Rickettsia
prowazekii. Durch diese Forschungen bereicherte da Rocha
Lima das Gebiet der Mikrobiologie um einen neuen Abschnitt:
die Rickettsien.
Gleichzeitig
befasste er sich auch mit Untersuchungen über das Fünftagefieber,
wobei er als Ursache eine Rickettsien-Art entdeckte, nämlich
R. pediculi, welche er 1917 beschrieb [17]. Ihm zu
Ehren wurde diese vermeintliche Rickettsien-Art lange Zeit Rochalimaea
quintana genannt.
1928 bot
ihm die brasilianische Regierung die Leitung der Abteilung für
Tier-Pathologie des Instituto Biológico in Sao Paulo
an, was zur endgültigen Rückkehr da Rocha Limas nach
Brasilien führte [18]. |
| Die
Familie der Bartonellaceae Phylogenetisch
betrachtet gehören die Bartonellen zur alpha-Subgruppe
der Proteobakterien und sind mit den Brucellen sehr eng verwandt
[19]. Bakterien der Gattung Bartonella sind kleine,
pleomorphe, leicht gebogene, gramnegative Stäbchen, welche
auf bluthaltigen Nährmedien oder in Zellkulturen bei 30-37°C
in Anwesenheit von 5% CO2 angezüchtet
werden können [20, 21, 22].
B.
bacilliformis war jahrzehntelang der einzige Vertreter
der Familie der Bartonellaceae, während die Familie
der Rochalimaeae von Anfang an den Rickettsien zugeordnet
war. Aufgrund von phänotypischen und genotypischen Gemeinsamkeiten
schlugen Brenner et al. 1993 vor, die Familie der Rochalimaeae
mit den damals dazugehörigen Spezies Rochalimaea quintana,
R. henselae, R. elizabethae und R. vinsonii
von den Rickettsien endgültig abzutrennen und der Familie
der Bartonellaceae zuzuordnen [23]. Wenig später,
1995, wurden auf Vorschlag von Birtles et al. auch die Familie
der Grahamellen mit den Spezies G. talpae und G.
peromysci sowie drei weitere neue Spezies, nämlich
B. doshiae, B. grahamii und B. taylorii
in die Familie der Bartonellaceae eingegliedert [19].
Danach ist die Anzahl der neu entdeckten Spezies sprunghaft
gestiegen. Es folgten 1996 die Spezies B. vinsonii subsp.
berkhoffii [24], welche möglicherweise durch Zecken
übertragen wird [25], und B. clarridgeiae [26],
1998 die Spezies B. alsatica [27] und 1999 drei weitere
neue Spezies: B. tribocorum [28], B. koehlerae
[29] und B. vinsonii subsp. arupensis [30]. Auch in
jüngster Zeit hat die Beschreibung neuer Spezies angedauert.
So konnte auch in unseren Regionen aus Blutkulturen von Rehen
aus dem Naturschutzgebiet Schönbuch bei Tübingen (Deutschland)
eine neue Spezies, nämlich B. schoenbuchii [31],
und aus Rehen aus Frankreich B. capreoli [32] angezüchtet
werden. Es lagern zur Zeit in einigen wissenschaflichen Laboratorien
noch weitere Bartonella-Isolate, die darauf warten, charakterisiert
zu werden (Tabelle 1).
Tabelle
1: Familie der Bartonellaceae und ihr
natürliches Reservoir, modifiziert nach [33]
| Spezies |
Jahr
der
Erstbeschr. |
Reservoir |
Vektor |
|
| 1.
B. bacilliformis |
1905
[34] |
Mensch |
Sandfliege |
| 2.
B. talpae |
1911
[35] |
Maulwurf |
? |
| 3.
B. quintana |
1917
[36] |
Mensch |
Kleiderlaus |
| 4.
B. peromysci |
1942
[37] |
Maus |
? |
| 5a.
B. vinsonii spp. vins. |
1946
[38] |
Wühlmaus |
? |
| 6.
B. henselae |
1992
[29, 40] |
Katze |
Katzenfloh |
|
7. B. elizabethae |
1993
[41] |
Ratte |
? |
| 8.
B. grahamii |
1995
[19] |
Maus |
? |
| 9.
B. taylorii |
1995
[19] |
Nager |
? |
| 10.
B. doshiae |
1995
[19] |
Nager |
? |
| 5b.
B. vins. spp. berkhoffii |
1996
[24] |
Hund |
Zecken
(?) |
| 11.
B. clarridgeiae |
1996
[26] |
Katze |
Katzenfloh |
| 12.
B. tribocorum |
1998
[28] |
Ratte |
? |
| 13.
B. alsatica |
1999
[27] |
Hase |
? |
| 14.
B. koehlerae |
1999
[29] |
Katze |
? |
| 5c.
B. vins. spp. arupensis |
1999
[30] |
Maus |
? |
| 15.
B. birtlesii |
2000
[42] |
Maus |
? |
| 16.
B. schoenbuchii |
2001
[31] |
Reh |
? |
| 17.
B. bovis (= B. weissii) |
2002
[32] |
Rind
/ Katze |
? |
| 18.
B. capreoli |
2002
[32] |
Reh |
? |
| 19.
B. washoensis |
2003
[43] |
Erdhörnchen |
? |
|
|
|
| Natürliches
Reservoir von Bartonellen
Das jeweils bekannte natürliche Reservoir der einzelnen
Bartonella-Spezies ist in Tabelle 1 aufgelistet.
Der Mensch
stellt bisher das einzige bekannte Reservoir für B.
bacilliformis und B. quintana dar.
Das Reservoir
für B. henselae stellen Katzen dar. Regnery et
al. [44] haben erstmals 1992 B. henselae aus der Blutkultur
einer Katze isoliert. In zahlreichen folgenden Untersuchungen
konnte gezeigt werden, dass Katzen, insbesondere junge, weibliche
Kätzchen, das Hauptreservoir für B. henselae
bilden. Streunende Katzen sind häufiger infiziert als Hauskatzen.
Die Tiere tragen den Erreger zum Teil monatelang im Blut (oft
intraerythrozytär), ohne jedoch selbst daran klinisch zu
erkranken [45]. Die Angaben über die bei Katzen gefundenen
Bakteriämien schwanken zwischen 16 und 89% bei streunenden
oder in Tierheimen untergebrachten Tieren und zwischen 3 und
47% bei Hauskatzen (Tabelle 2). Dabei wurden Keimzahlen von
3 bis mehr als 1.000 Keime/ml Blut bestimmt.
Tabelle
2: Bakteriämie-Raten bei Katzen aus unterschiedlichen
geographischen Regionen, modifiziert nach [65]
| Land |
Tierhaltung |
Bakteriämie
(in %) |
Literatur |
|
| 1.
USA, Kalifornien |
Tierheim |
41
|
[48] |
| 2.
USA |
Katzen
von KKK-Patienten
Hauskatzen |
89
28 |
[66] |
3.
USA, Davis
San Francisco
Davis
Sacramento |
Hauskatzen
Hauskatzen
Tierheim
Tierheim |
4,4
47,7
53
70,4 |
[67] |
| 4.
USA |
Tierheim |
89 |
[46] |
| 5.
USA |
Hauskatzen |
12 |
[52] |
|
| 6.
Japan |
Hauskatzen |
9,1
|
[68] |
| 7.
Japan |
Hauskatzen |
8,2 |
[50] |
| 8.
Australien |
Hauskatzen
streunende Katzen |
16
40
|
[69] |
| 9.
Indonesien |
streunende
Katzen |
21
|
[55] |
| 10.
Philippinen |
Hauskatzen |
19 |
[54] |
| 11.
Simbabwe |
Hauskatzen |
8 |
[70] |
|
| Europa:
|
| 12.
Deutschland / Freiburg |
Hauskatzen |
13 |
[45] |
| 13.
Deutschland/ Berlin |
Hauskatzen
streunende Katzen |
1
18,7
|
[51] |
| 14.
Frankreich |
streunende
Katzen |
16 |
[53] |
| 15.
England |
Hauskatzen |
9,4 |
[71] |
| 16.
Italien |
Hauskatzen |
9,7 |
[72] |
| 17.
Niederlande |
Tierheim |
8 |
[57] |
| 18.
Norwegen |
Hauskatzen,
Tierheim |
0 |
[73] |
|
|
Serologisch
wurden bei den Katzen je nach geographischer Region und Tierhaltung
Antikörper gegen B. henselae in 4-100% der Tiere
nachgewiesen. Die Seroprävalenz in Österreich liegt
bei 33% [46].
Katzenflöhe
übertragen B. henselae sehr zuverlässig von
Katze zu Katze [47, 48], was durchaus erklären würde,
warum in Tierheimen sehr viel höhere Durchseuchungen gefunden
werden als in Hauskatzenpopulationen. Gleichzeitig wird die
Durchseuchung der Tiere auch von geographischen und klimatischen
Gegebenheiten bestimmt. Katzen aus kälteren geographischen
Regionen (z.B. Alaska) waren wesentlich seltener infiziert als
solche aus wärmeren Gegenden [49].
Neben B.
henselae wurden in den letzten Jahren noch 3 weitere Bartonella-Arten
aus Katzenblutkulturen angezüchtet: B. clarridgeiae,
B. koehlerae und B. weissii (= B. bovis).
B.
clarridgeiae kommt in Katzen ebenfalls weltweit vor, wenngleich
die Bakteriämiehäufigkeit von 1-42% etwas geringer
ist als für B. henselae. Die nachgewiesenen Bakteriämieraten
für B. clarridgeiae liegen bei ca. 1% in Japan
[50] und Deutschland [51], bei ca. 12% in den USA [52] und zwischen
16 und 42% in Frankreich [53], den Philippinen [54] und Indonesien
[55]. Doppelinfektionen von B. henselae und B.
clarridgeiae wurden bei den Tieren ebenfalls beobachtet:
5 der 436 (1,14%) Hauskatzen bei Gurfield [56]; 5 der 113 (4,4%)
Katzen bei Bergmans [57], 4 von 31 (13%) bei Chomel [54] und
1 von 450 Katzen in Japan [50]. Bei Langzeituntersuchungen über
einen Zeitraum von 3 Jahren wurde bei einer Hauskatze eine Bakteriämie
durch B. clarridgeiae über 18 Monate nachgewiesen
[52]. Auch in Katzenflöhen wurde B. clarridgeiae
bereits gefunden [57], wodurch eine Übertragung durch diesen
Vektor wie bei B. henselae wahrscheinlich wird.
Alle anderen
Bartonella-Spezies wurden aus Blutkulturen (meist intraerythrozytär)
von verschiedenen Säugetieren isoliert. Jüngste Untersuchungen
haben gezeigt, dass Bartonella-Arten auch bei Kaninchen (30%),
Bisamratten (14%), verschiedenen Mausarten (70-85%), Rehen (98%)
[58] sowie bei Kojoten (32%), Hunden (9%), Elchen (17%), Rindern
(49%), Fleischrindern (89%), Milchkühen (17%), Panthern
(6%), Luchsen (53%) und Pumas (35%) [59] vorkommen. Eine vertikale
Übertragung von Bartonella spp. wurde in 58% (18/31)
der Embryos und in 37% (7/19) der Neugeborenen von Weißfußmäusen
(Peromyscus leucopus) und wild lebenden Ratten (Sigmodon hispidus)
beobachtet. Die Isolate von den infizierten Muttertieren waren
phylogenetisch homolog mit denen der Nachkommen [60].
Kürzlich
wurde Bartonella-DNA auch in 60% der untersuchten Zecken (Ixodes
ricinus) in den Niederlanden gefunden, welche weder als
B. henselae noch als B. quintana identifiziert
werden konnte, zum Teil in ihrer Sequenz jedoch große
Ähnlichkeiten zu B. vinsonii zeigte [61]. Aus
Zecken der Gattung Ixodes scapularis aus den USA [62] sowie
aus Ixodes ricinus aus Italien [63] wurde kürzlich
in 1,45% der untersuchten Zecken B. henselae-DNA nachgewiesen.
Serologisch
konnten Bartonella-Antikörper in vielen Zootieren wie Leopard,
Tiger, Löwe, Jaguar, Puma, Wildkatze u.a. nachgewiesen
werden [64]. Die meisten dieser jüngst isolierten Bartonella-Arten
sind noch nicht näher charakterisiert, sodass in Zukunft
mit weiteren neuen Spezies gerechnet werden muss. |
| Humanpathogene
Bartonella-Arten Von
den 19 bisher beschriebenen Bartonella-Arten sind inzwischen
8 Spezies als humanpathogen bekannt (Tabelle 3). Bartonella
bacilliformis und entsprechend die Carrión-Krankheit
kommt endemisch nur in den südamerikanischen Anden vor.
Die weltweit häufigsten und in unseren Regionen relevantesten
Infektionen werden durch B. henselae und B. quintana
hervorgerufen.
Tabelle
3: Bisher bekannte humanpathogene Bartonella-Spezies
| Bartonella-Art |
Jahr
der |
Reservoir |
Vektor |
Erkrankung |
Jahr |
| |
Beschreibung |
|
der
Beschreibung |
|
| 1.
B. bacilliformis |
1905 |
Mensch |
Sandfliege |
Oroya-Fieber
Verruga peruana |
1870
1870 |
| 2.
B. quintana |
1917 |
Mensch |
Kleiderlaus |
Fünftagefieber
BA/Endokarditis |
1917
1992/93 |
| 3.
B. henselae |
1992 |
Katze |
Katzenfloh |
Katzenkratzkrankheit
BA / Endokarditis |
1950
1992/93 |
| 4.
B. elizabethae |
1993 |
Ratte |
? |
Endokarditis
Neuroretinitis |
1993
1998 |
| 5.
B. clarridgeiae |
1996 |
Katze |
Katzenfloh |
Katzenkratzkrankheit |
1997 |
| 6.
B. grahamii |
1995 |
Maus |
? |
Neuroretinitis |
1999 |
| 7a.
B. vins. spp. arupensis |
1999 |
Maus |
? |
Fieber,
Bakteriämie |
1999 |
| 7b.
B. vins. spp. berkhoffii |
1996 |
Hund |
Zecken
(?) |
Endokarditis |
2000 |
| 8.
B. washoensis |
2002 |
Erdhörnchen |
? |
Endokarditis |
2002 |
|
|
Von Bartonella
elizabethae existiert bisher nur ein einziges
humanes Isolat. Es wurde 1993 von Daly [41] aus dem Blut eines
immungesunden Patienten mit einer Endokarditis isoliert. Fieber,
Müdigkeit, Kurzatmigkeit, Gewichtsverlust und ein diastolisches
Herzgeräusch waren die wesentlichen klinischen Symptome.
Echokardiographisch wurden ausgedehnte Vegetationen an der Aorten-
und der Tricuspidal-Klappe nachgewiesen.
Kürzlich
wurde ein zweiter Fall einer B. elizabethae-Infektion
beschrieben [74]. Es handelt sich hierbei um einen 31-jährigen
Mann mit einer Leber-Neuroretinitis, der einige Wochen nach
dem Biss eines Waschbären einen plötzlichen Visus-Verlust
durch ein stark ausgeprägtes Papillenödem mit weißlichen
Netzhaut-Exsudaten am rechten Auge verzeichnete. Weitere klinische
Symptome sowie eine Katzenexposition lagen nicht vor.
Die Diagnose wurde serologisch durch einen geringgradigen Antikörper-Titeranstieg
(1:128) gegen B. elizabethae gestellt, bei negativen
Titern gegen andere infrage kommende Erreger.
Das eigentliche
Reservoir von B. elizabethae ist bisher nicht genau
bekannt. Es liegen jedoch Berichte vor, nach denen diese Bakterien
in Nagetieren (Ratte) gefunden wurden [75, 76]. Ob auch hier
Ektoparasiten als Vektor bei der Übertragung der Erreger
eine Rolle spielen, ist noch nicht bekannt.
Bartonella
clarridgeiae wurde erstmals 1995 von Clarridge
et al. [77] isoliert. Das Isolat fiel durch seine Flagellen
im Zuge von Untersuchungen eines an B. henselae erkrankten
HIV-positiven Patienten mit Katzenkratzkrankheit auf und wurde
aus der Blutkultur seiner Katze isoliert. Die genaue Charakterisierung
erfolgte 1996 durch Lawson et al. [26].
Zwei Fälle
von menschlichen Erkrankungen durch B. clarridgeiae
sind bisher beschrieben. Kordick et al. [78] berichten 1997
über einen Veterinär, welcher nach einem Katzenbiss
an Fieber, Kopfschmerzen und rechts-axillärer Lymphknotenschwellung
erkrankt war. Serologisch wurden Antikörper gegen B.
clarridgeiae (1:1.024), jedoch nicht gegen B. henselae,
B. quintana oder B. elizabethae nachgewiesen.
Aus der Blutkultur der entsprechenden Katze wurde B. clarridgeiae
isoliert.
Der zweite
Fall wurde 1998 von Margileth et al. beschrieben [79]. Es handelt
sich hierbei um einen 35-jährigen Patienten mit Fieber,
Schüttelfrost, Nachtschweiß, Kopfschmerzen, Bewusstseinstrübung
und Brustwandabszess, Symptome, welche als Katzenkratzkrankheit
interpretiert wurden. Aus einer Eiterprobe des Abszesses wurde
Streptococcus pneumoniae angezüchtet. Da der Patient
drei streunende Katzen aufgenommen hatte, wurde retrospektiv
auf Antikörper gegen Bartonellen untersucht. Es fand sich
ein isolierter niedriger Titer von 1:128 gegen B. clarridgeiae,
woraus auf eine solche Infektion geschlossen wurde. Aus der
Blutkultur einer Katze konnte ebenfalls B. clarridgeiae
angezüchtet werden. Eine Infektion durch B. clarridgeiae
muss in diesem Fall durch den niedrigen serologischen Titer
sowie durch den Nachweis von Pneumokokken aus dem Brustwandabszess
äußerst kritisch betrachtet werden.
B.
vinsonii subsp. arupensis wurde erst kürzlich
aus der Blutkultur eines Rinderzüchters mit Fieber isoliert
[30]. Die gleichen Isolate wurden auch in Mäusen gefunden,
welche das natürliche Reservoir für diese Subspezies
darstellen.
Diese einzelnen
Fallberichte verdeutlichen, dass auch die Liste der menschenpathogenen
Bartonella-Spezies in nächster Zukunft noch erweitert werden
könnte.
|
| Bartonella
bacilliformis und Carrión-Krankheit (Oroya-Fieber
und Verruga peruana)
Erreger:
Der älteste und lange Zeit der einzige Vertreter der Familie
der Bartonellaceae ist Bartonella bacilliformis,
der Erreger des Oroya-Fiebers und der Verruga peruana. Die Bakterien
wurden 1905 von dem peruanischen Arzt Alberto Barton in den
Erythrozyten von Patienten mit Oroya-Fieber erstmals beschrieben
[34], und 1926 gelang die Anzüchtung der Keime auf bluthaltigen
Nährböden [80]. Die ausgeprägte Beweglichkeit
verdankt B. bacilliformis einem Bündel von 2 bis
16 unipolaren Flagellen [81], welche auch an der Adhäsion
an die Erythrozyten beteiligt sind. Mit Antiflagella-Antikörpern
kann diese Bindung eindeutig reduziert werden [82].
Reservoir
und Übertragung: Das einzige bislang bekannte
Reservoir für B. bacilliformis ist der Mensch.
Die Übertragung erfolgt durch die Blut saugende Sandfliege
Lutzomya verrucarum.
Epidemiologie:
Jüngste Studien belegten, dass in Endemiegebieten in Peru
mehr als ein Drittel (38%) der gesunden Bevölkerung Antikörper
gegen B. bacilliformis aufweisen [83]. In einem Endemiegebiet
im Distrikt Caraz, Peru, gaben 42% der Bevölkerung anamnestisch
an, entweder an der akuten febrilen Form oder der chronisch-verrukösen
Form der Carrión-Krankheit erkrankt gewesen zu sein.
In 2/3 der Fälle trat die Erkrankung vor dem 10. Lebensjahr
auf. Die Mehrzahl der Erkrankungen (89%) wurde zwischen Januar
und Juni beobachtet. In der gleichen Studie konnte gezeigt werden,
dass nach Therapie und klinischer Symptomfreiheit immerhin noch
14% der Patienten nach akutem Oroya-Fieber und 22% der Patienten
mit chronischer Verruga peruana eine Bakteriämie mit B.
bacilliformis aufwiesen [84]. Demnach stellen asymptomatische,
bakteriämische Patienten das Reservoir für B.
bacilliformis dar. Ein weiteres Vorkommen von B. bacilliformis
im Tier- oder Pflanzenreich wurde bisher nicht gefunden. Auch
Untersuchungen von Herrer und Mitarbeitern [85] zeigten, dass
in endemischen Gebieten bis zu 10% der Individuen eine asymptomatische
Infektion aufweisen.
Die Carrión-Krankheit
(Synonyme: Oroya-Fieber, Verruga-Fieber, Verruga peruana, Guaitará-Fieber,
oder einfach nur Bartonellose) ist eine akute hoch fieberhafte
Erkrankung mit einem typischen biphasischen Verlauf. Nach einer
Inkubationszeit von 8 bis 100 (Durchschnitt 21) Tagen treten
unspezifische Symptome wie allgemeines Krankheitsgefühl,
Schüttelfrost, Fieber, Kopf- und Gelenkschmerzen auf. Kennzeichen
der Akutphase (Oroya-Fieber) ist die ausgeprägte
Anämie durch den massiven Befall der Erythrozyten mit B.
bacilliformis (in schwersten Fällen 95-100%), gefolgt
von hohem Fieber, Dyspnoe, Lymphadenopathie, Hepatosplenomegalie
und gelegentlicher Meningoenzephalomyelitis [1, 2, 81, 86].
Die Zeitdauer dieser Phase beträgt in der Regel 2 bis 4
Wochen und hat unbehandelt eine Letalitätsrate von 40%
[2].
Ein bis
mehrere Monate nach dem akuten Stadium treten bei den Patienten
knotige Hautveränderungen unterschiedlicher Zahl und Größe
auf (Spätphase, kutane Form, Verruga peruana).
Am häufigsten ist die miliare Form mit vielen hämangiomähnlichen
Läsionen der Dermis. Die Knoten bei der nodulären
Form sind größer, weniger zahlreich und besonders
an den Streckseiten der Extremitäten lokalisiert. Neben
der Haut können auch die Schleimhäute des Gastrointestinaltraktes,
des Urogenitaltraktes und der serösen Höhlen befallen
sein. Kopfschmerzen sowie Knochen- und Gelenkschmerzen sind
mögliche Begleitsymptome [84]. Die Hautläsionen sind
schmerzlos, bluten sehr leicht, persistieren durchschnittlich
3 bis 4 Monate und heilen danach meist spontan ab. Histologisch
zeigen die vaskulären Hautveränderungen eine endotheliale
Proliferation und eine histiozytäre Hyperplasie mit anschließender
Fibrose und Nekrose bei Superinfektion. Diese Proliferation
der subdermalen Gefäßendothelien wird durch bisher
nicht genau beschriebene Mediatoren von B. bacilliformis
angeregt [87, 88]. Elektronenmikroskopisch finden sich kokkoide
Formen von B. bacilliformis im interstitiellen Gewebe
[81].
Die Diagnose
der Carrión-Krankheit beruht auf dem intraerythrozytären
Nachweis der Erreger im Giemsa-gefärbten Blutausstrich,
der Anzüchtung der Bakterien aus Blut oder Hautläsionen
auf bluthaltigen Nährmedien bei 28-32°C, serologisch
durch den Nachweis von Antikörpern [83, 89] oder molekularbiologisch
durch PCR-Amplifikation von Erreger-DNA [90].
Therapie:
Therapeutisches Mittel der Wahl in der Akutphase ist Chloramphenicol,
alternativ auch Tetracyclin und neuerdings auch Erythromycin,
was bei rechtzeitigem Einsatz zu einem schnellen Fieberabfall
innerhalb von 48 h führt [1]. Doch auch unter dieser Therapie
liegt die Letalität noch bei 8% [2]. Das erste Stadium
hinterlässt eine unterschiedlich stark ausgeprägte
Suppression der zellulären Immunität, wodurch Komplikationen
durch opportunistische Erreger (Mycobacterium tuberculosis,
Toxoplasma gondii, Salmonellen, Shigellen) beobachtet wurden
[91, 92, 93].
Zur Behandlung
der verrukösen Form werden Streptomycin, Rifampicin oder
Tetracyclin eingesetzt. Bewohner aus den Endemiegebieten erkranken
selten an dem Akutstadium, und die Verruga peruana ist normalerweise
die einzige Manifestation der Erkrankung in diesem Patientenkollektiv.
|
| Bartonella
quintana und Fünftagefieber
Der Erreger
des Fünftagefiebers wurde als Rickettsia quintana
von Schmincke 1917 erstmals beschrieben [36]. Im gleichen Jahr
beschrieb auch Henry da Rocha Lima den Erreger als Rickettsia
pediculi im Blut der Patienten sowie im Darm von Kleiderläusen
und wies schon damals darauf hin, dass sich diese Rickettsien-Art
überwiegend im Lumen des Magen-Darm-Kanals der Läuse
vermehrt und im Gegensatz zu Rickettsia prowazekii nur
ausnahmsweise in die Zellen eindringt [17]. Andere Synonyme
für diesen Erreger waren R. weigli (94), R.
wolhynica (95) und R. rochalimae [96]. Das Fünftagefieber
war eine Xenodiagnose und wurde mit dem „Läusetest“
diagnostiziert. Nicht infizierte Läuse wurden den Patienten
angesetzt und die Bakterien ca. eine Woche später im Magen-Darm-Kanal
der Parasiten nachgewiesen. Erste Hinweise auf das langsame
Wachstum des Erregers finden sich schon 1916 in den Beobachtungen
Töpfers [97] an Läusen von Erkrankten: „Erst
nach dem 5. Tag ließen sich die Organismen zunächst
vereinzelt, vom 8. Tage ab in großer Menge nachweisen.“
Der Gastrointestinaltrakt der Läuse war gleichzeitig das
zuverlässigste Kulturmedium, bis Vinson und Fuller 1961
die Anzucht auf zellfreien Medien gelang [98]. Dabei wurde dieser
Erreger von den obligat intrazellulär wachsenden Rickettsien
abgetrennt und zu Ehren von Henry da Rocha Lima, welcher Herausragendes
auf dem Gebiet der Rickettsien-Forschung geleistet hat, in Rochalimaea
quintana umbenannt. Um die Koch’schen Postulate zu
erfüllen, wurden die angezüchteten Bakterienkulturen
Freiwilligen inokuliert, welche danach auch an Fünftagefieber
erkrankten [99].
Nach den
beiden Weltkriegen geriet das Fünftagefieber sowie sein
Erreger lange Zeit in Vergessenheit. 1992 wurde Rochalimaea
quintana als ein Erreger der Bazillären Angiomatose
gleichsam wiederentdeckt [100]. Ein Jahr später (1993)
wurde der extrazellulär wachsende Keim endgültig von
den Rickettsien abgetrennt und in Bartonella quintana umbenannt
[23].
Reservoir
und Übertragung: Das einzig bisher bekannte Reservoir
für B. quintana ist der Mensch. Infiziert sind
insbesondere immunsupprimierte, HIV-positive Patienten, Alkoholkranke
und Obdachlose.
Schon kurz
nach dem Auftreten der Erkrankung (1916) wurde von H. da Rocha
Lima erkannt, dass die Kleiderlaus der wichtigste Überträger
des Fünftagefiebers ist [101]. In Läusen von 73% (51/70)
der Patienten mit Fünftagefieber konnte er den Erreger
im Magen-Darm-Kanal der Parasiten nachweisen, während in
der Kontrollgruppe nur 18% (6/33) der Patienten von infizierten
Läusen besiedelt waren [17]. Lausbefall beim Menschen ist
jedoch kein Relikt der Vergangenheit. Eine Zunahme von B.
quintana-Infektionen bei Obdachlosen [102] und alkoholabhängigen
Patienten [103] wird schon seit einigen Jahren beobachtet, und
schon 1995 fragten Relman [104] und Stein [105]: „Has
trench fever returned?“ Aktuelle Untersuchungen in Russland
haben gezeigt, dass 19% der Obdachlosen in Moskau mit Kleiderläusen
besiedelt sind und immerhin 12,3% dieser Parasiten mit B.
quintana infiziert waren [106]. Eine vergleichbar hohe
Prävalenz (8%) von B. quintana in Kleiderläusen
wurde auch bei dem Fünftagefieber-Ausbruch in Burundi gefunden
[16].
Fünftagefieber:
Während der beiden Weltkriege waren vor allem die von Kleiderläusen
befallenen Soldaten Opfer der Erkrankung. In seinem Schlusssatz
schrieb Rocha Lima: „Das wolhynische Virus ist nicht nur
während des Fieberstadiums nachweisbar, sondern kann auch
längere Zeit nach dem Verschwinden der Krankheitserscheinungen
im Blute vorhanden sein, sodass mit der Verbreitung der Krankheit
durch gesunde Virusträger gerechnet werden muss.“
[17] Bartonella quintana wurde bis zu 8 Jahre nach
Erkrankung im Blut von Patienten nachgewiesen, und wiederholtes,
mehr als 8-maliges Erkranken an Fünftagefieber wurde beschrieben
[9]. Dabei konnte zwischen einem Rezidiv und einer Reinfektion
nicht immer eindeutig unterschieden werden.
Heute treten
B. quintana-Infektionen im Wesentlichen bei Obdachlosen
und alkoholkranken Patienten in Form von Endokarditiden oder
Bakteriämien sowie bei immunsupprimierten, HIV-positiven
Patienten als Bazilläre Angiomatose, Peliosis hepatis,
Bakteriämien und Endokarditiden auf [15].
Die Diagnose
wird serologisch, molekularbiologisch oder auch durch die Anzucht
der Erreger gestellt. Dabei muss betont werden, dass die Kultur
äußerst unzuverlässig und nur sporadisch positiv
ist.
|
| Bartonella
henselae und Katzenkratzkrankheit
Erreger:
Den ersten Hinweis auf die Existenz einer neuen Bartonella-Spezies
erbrachte Relman 1990 [107]. Mittels eubakterieller PCR-Amplifikation
aus Gewebebiopsien und Sequenzierung des 16S rRNA-Gen-Amplifikates
gelang es ihm, den Erreger der Bazillären Angiomatose als
einen engen Verwandten von Bartonella quintana zu identifizieren,
obwohl der Keim nicht angezüchtet werden konnte. Fast gleichzeitig
isolierte Slater [108] ein mit Rochalimaea quintana
eng verwandtes Bakterium aus dem Blut eines fieberhaften, immunsupprimierten
Patienten. 1992 wurde die neue Spezies Rochalimaea henselae
aus der Blutkultur eines HIV-positiven Patienten mit Fieber
isoliert und charakterisiert [39] und gleichzeitig bei weiteren
HIV-positiven Patienten mit Bazillärer Angiomatose und
Peliosis hepatis beschrieben [40]. Ein Jahr später (1993)
wurde auch sie von den Rickettsien abgetrennt, in Bartonella
henselae umbenannt und in die Familie der Bartonellaceae
eingegliedert [23].
Reservoir
und Übertragung: Bei der KKK handelt es sich um
eine Zoonose mit einer Inkubationszeit von 3 bis 10 Tagen. Die
Erreger werden durch Beißen oder Kratzen von den Katzen
auf den Menschen übertragen. Auch eine Übertragung
über Katzenflohstiche erscheint wahrscheinlich. Übertragungen
von Mensch zu Mensch wurden bisher nicht beobachtet.
Die Katzenkratzkrankheit
kommt weltweit vor und korreliert eng mit dem Vorhandensein
von Katzen, mit einer Katzenexposition, dem Alter der Katze
sowie dem Vorkommen von Katzenflöhen.
Das klinische
Bild einer Infektion durch B. henselae hängt
entscheidend vom Immunstatus des Patienten ab. Bei immunkompetenten
Patienten führt sie typischerweise zur Katzenkratzkrankheit,
während bei immunsupprimierten, insbesondere HIV-positiven
Patienten Krankheitsbilder wie die Bazilläre Angiomatose,
die Peliosis hepatis, eine Endokarditis, osteolytische Läsionen
sowie generalisierte Infektionen entstehen können.
Die Katzenkratzkrankheit
wurde von dem Franzosen Robert Debré 1950 erstmals beschrieben
[109]. Nur wenig später erschien auch aus den Vereinigten
Staaten ein erster Bericht über diese Erkrankung von Greer
und Keefer [110], und bereits 1954 berichteten Daniels und MacMurray
[111] über ein Kollektiv von 160 Patienten mit KKK. Bis
1990 erschienen mehr als 750 Veröffentlichungen, in welchen
über mehr als 3.000 Patienten mit KKK berichtet wurde [112].
Die Katzenkratzkrankheit
(KKK) ist eine recht häufig auftretende Infektionskrankheit,
welche sich typischerweise in Form einer subakuten, gutartigen
regionalen Lymphknotenschwellung manifestiert, und ist eine
der häufigen Differentialdiagnosen bei Lymphknotenerkrankungen.
In den Vereinigten Staaten wird mit einer jährlichen Inzidenzrate
von 22.000 ambulanten (9,3/100.000 Einwohner) und mehr als 2.000
(0,86/100.000 hospitalisierte Patienten) stationären Fällen
gerechnet [113]. Bis zu 11% der Patienten mit KKK werden stationär
behandelt. Vergleichbare Daten liegen für Deutschland bzw.
Europa nicht vor. Betroffen sind nicht nur Kinder [114, 115],
sondern häufig auch Erwachsene [116, 117, 118]. Besonders
bei diesen wird die Erkrankung zunächst oft als malignes
Geschehen fehldiagnostiziert [119]. In einer prospektiven Studie
bei Patienten mit Lymphknotenschwellungen im Kopf-Hals-Bereich
aus der HNO-Klinik in Freiburg konnten wir in 61 von 454 Fällen
(13,4%) eine KKK diagnostizieren [120]. Diese hohe Inzidenz
hängt sicherlich mit einer gewissen Vorselektion der Patienten
durch die niedergelassenen HNO-Kollegen ab, zeigt allerdings
auch, dass die KKK auch in unseren Breiten keine Rarität
darstellt.
Die KKK
wurde anfangs überwiegend von Pädiatern beschrieben,
was irrtümlicherweise zur Annahme verleitete, dass es sich
hier überwiegend um eine Kinderkrankheit handelt. Carithers
[114] berichtet in einer Übersichtsarbeit über 1.200
Patienten, dass 87% der Erkrankten jünger als 18 Jahre
waren. Dagegen waren in einer Studie von Hamilton et al. [121]
von 246 Patienten 43% älter als 21 Jahre. Die KKK tritt
somit in jedem Lebensalter auf und ist eine der wichtigsten
Differentialdiagnosen bei Lymphknotenschwellungen, an welche
zur Zeit jedoch noch viel zu selten gedacht wird.
Als typische
Katzenkratzkrankheit wird die klinisch-klassische Verlaufsform
bezeichnet. Sie tritt bei nicht immunsupprimierten Patienten
auf und hat meist einen charakteristischen Verlauf: Die Patienten
berichten über eine Kratz- oder Bissverletzung durch Katzen,
und die Erkrankung beginnt in der Mehrzahl der Fälle (50-76%)
etwa 3 bis 10 Tage nach Katzenkontakt mit einer kleinen, rot-braunen
Papel an der verletzten Hautstelle. Die Papeln werden ein bis
mehrere mm groß, sind meist nicht schmerzhaft und persistieren
nur wenige Tage oder auch einige Wochen lang. Diese Primärläsionen
werden gelegentlich übersehen oder bei Persistenz als nicht
abheilende Insektenstiche fehlinterpretiert. Etwa 2 Wochen (7-60
Tage) nach Infektion treten im Abflussgebiet der Primärläsion
ein oder mehrere weiche, meist schmerzhafte regionale Lymphknotenschwellungen
auf. Sie bleiben oft die einzigen klinischen Symptome der Erkrankung.
Am häufigsten betroffen sind die axillären Lymphknoten
(46%) (Abb. 1), gefolgt vom zervikalen oder submandibulären
(26%) und inguinalen bzw. femoralen (17%) Bereich. Meist ist
nur die anatomische Region proximal der Inokulationsstelle beteiligt,
d.h. es liegen nur einseitige Lymphknotenschwellungen vor. Sind
mehrere Lymphknotenstationen betroffen, sollte nach zusätzlichen
Inokulationsstellen gefahndet werden. Die Lymphknotenschwellungen
erreichen ca. 2 bis 3 Wochen nach Erscheinen ihre durchschnittliche
Größe von 1 bis 5 cm, können jedoch auch bis
zu 12 cm groß werden. In dieser Form persistieren sie
weitere 2-3 Wochen und heilen dann innerhalb der nächsten
2-3 Wochen wieder ab. Bei unkompliziertemVerlauf ist somit bei
der typischen KKK mit einer Spontanheilung nach 2-4 Monaten
zu rechnen. Es gibt große Unterschiede im klinischen Verlauf
der einzelnen Erkrankungen. Viele Lymphknotenschwellungen bleiben
klein und unauffällig und werden meist nicht diagnostiziert.
Abbildung
1: Katzenkratzkrankheit, axilläre Lymphknotenschwellung
(Freundlicherweise von Dr. K. Deichmann, Kinderklinik
Freiburg, zur Verfügung gestellt)
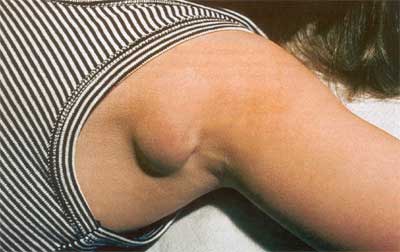
|
Einige
Erkrankungsfälle (1-2%) können sehr viel schwerer
und protrahiert über mehrere Monate verlaufen. In 10-15%
der Fälle entwickelt sich eine Rötung mit Fluktuation
und anschließender eitriger Einschmelzung der Lymphknoten.
Mehr als die Hälfte der Erkrankungen verlaufen afebril.
Leichtes Fieber bis 39°C tritt in ca. 30% der Fälle
auf und ca. 10% der Patienten haben hohes Fieber über 39°C.
Zusätzlich können andere allgemeine Symptome wie Kopfschmerzen,
Übelkeit oder Erbrechen auftreten. Seltener kommt es zu
Arthralgien, Myalgien, abdominellen Schmerzen, Exanthemen oder
einer Splenomegalie [122, 123, 114, 112, 124, 125, 126].
Die Erkrankung
tritt weltweit, häufiger jedoch in feuchten und wärmeren
geographischen Regionen auf. Sie wird das ganze Jahr über
diagnostiziert, eine saisonale Häufung findet sich in den
Herbst- und Wintermonaten [127, 112]. Familiäre Ausbrüche
sind bekannt. Meist handelt es sich hierbei um Geschwister,
welche innerhalb von wenigen Wochen nacheinander erkranken.
Oft wird bei einer Erkrankung über den kürzlichen
Neuerwerb eines jungen Kätzchens berichtet [128].
Atypische
Katzenkratzkrankheit: Atypische Formen treten in 5-15%
der Erkrankungsfälle auf und können sehr unterschiedlich
verlaufen. Die häufigsten Manifestationsformen sind in
Tabelle 4 wiedergegeben.
Tabelle
4: Klinische Verlaufsformen bei atypischer KKK,
nach Margileth [129]
| |
| Parinauds
okuloglanduläres Syndrom |
6 |
| Enzephalopathie |
2,4 |
| Systemische
KKK |
2 |
| Neuroretinitis |
1,4 |
| Erythema
nodosum |
0,8 |
| thrombozytopenische
Purpura |
0,4 |
| Hepatosplenomegalie |
0,3 |
| atypische
Pneumonie |
0,2 |
| Osteomyelitis |
0,3 |
|
|
In etwa
2-17% aller Erkrankungen manifestiert sich eine B. henselae-Infektion
am Auge als Parinauds okuloglanduläres Syndrom mit granulomatöser
Konjunktivitis und Parotitis-ähnlicher präaurikulärer
Lymphadenopathie. In den charakteristischen rötlich-gelben
Granulomen von wenigen mm bis mehr als 1 cm Durchmesser können
die Erreger nachgewiesen werden. Das betroffene Auge ist entzündlich
gerötet und meist stark geschwollen. Sehstörungen
können auftreten, bilden sich jedoch fast immer innerhalb
von einigen Wochen vollständig zurück [130]. Als möglicher
Infektionsweg wird eine indirekte Inokulation des Erregers durch
Reiben mit der Hand nach Katzenkontakt diskutiert, seltener
ist eine direkte Verletzung durch die Katze. Die Erkrankung
ist selbstlimitierend und heilt nach 2-4 Monaten komplikationslos
ab [122, 123].
Neurologische
Komplikationen treten in ungefähr 1-7% der Patienten mit
KKK auf [122]. Die häufigsten Symptome sind: Enzephalitis,
aseptische Meningitis, Krampfanfälle, Myelitis, Radikulitis,
Polyneuritis, Paraplegie, Neuroretinitis und zerebrale Arteriitis.
Bei Erwachsenen treten diese Komplikationen häufiger auf
als bei Kindern. Die Symptome erscheinen sehr plötzlich,
in der Regel 1 bis 6 Wochen nach Auftreten der Lymphknotenschwellungen.
Krämpfe sind häufig die ersten Anzeichen einer ZNS-Beteiligung,
sie verlaufen oft protrahiert und rezidivierend und werden in
ca. 80% der Patienten mit neurologischen Komplikationen beobachtet.
Weiterhin sind Desorientiertheit, Verwirrtheitszustände
bis zum Koma beschrieben, ebenso Hemiparesen, Reflexanomalien,
Tremor und Kleinhirnataxie. Das Computertomogramm des Schädels
ist in der Regel unauffällig, jedoch zeigt das Elektroenzephalogramm
häufig Veränderungen. Infarkte und Vaskulitiden kommen
nur vereinzelt vor. Das periphere Blutbild ist meist unauffällig
und im Liquor findet sich gelegentlich eine lymphozytäre
Pleozytose [123, 131, 132].
Systemische
(disseminierte) Katzenkratzkrankheit: Bei der systemischen
KKK persistieren die Symptome über einen längeren
Zeitraum. Über Wochen persistierendes hohes Fieber, Nachtschweiß,
generalisierte Lymphknotenschwellungen, Krankheitsgefühl,
Müdigkeit, Myalgien, Arthralgien, Hauterscheinungen, Gewichtsverlust
und Hepatosplenomegalie sind die am häufigsten beobachteten
Symptome. Gelegentlich finden sich Milz- und Leberabszesse.
Sehr selten ist der Befall von abdominellen Lymphknoten oder
von Knochen, gefolgt von osteolytischen Lä-sionen oder
einer Osteomyelitis. Desgleichen sind atypische Pneumonien,
Pleuraergüsse und paravertebrale Abszesse bei KKK beschrieben
[123, 112, 133]. Auch eine Paronychie nach Katzenbiss kann im
Einzelfall durch B. henselae bedingt sein [134]. Gelegentlich
kann bei immunkompetenten Patienten eine disseminierte Katzenkratzkrankheit
auch ohne periphere Lymphknotenschwellungen ablaufen. Hämatologische
Manifestationen bei systemischer KKK sind hämolytische
Anämie mit Hepatosplenomegalie, thrombozytopenische Purpura
und Eosinophilie. Rezidive sind zwar selten, aber dennoch möglich.
Auch bei diesen schwer verlaufenden Fällen von KKK erfolgt
eine Spontanheilung innerhalb von mehreren Monaten [135, 112,
136].
Dank neuer
diagnostischer Möglichkeiten wurde in den letzten fünf
Jahren ein ständig wachsendes Spektrum an klinischen Symptomen
beim Menschen als Bartonella-Infektionen erkannt [120, 132,
135, 137, 138]. Eine Paronychie durch B. henselae nach
Katzenbiss [134] sowie eine initial als Hypopharynxkarzinom
fehldiagnostizierte KKK bei einem Landwirt [119] sind auch in
unserem Klinikum nur einzelne Beispiele dafür.
|
Andere
Infektionen durch B. henselae und B. quintana
Bei immunsupprimierten
Patienten sind die Bazilläre Angiomatose, die Bazilläre
Peliosis hepatis, osteolytische Läsionen und Fieber unklarer
Genese die häufigsten Manifestationen einer Bartonella-Infektion.
Die Bazilläre
Angiomatose (BA) wurde erstmals 1983 von Stoler [139]
et al. als atypische subkutane Läsionen bei einem HIV-positiven
Patienten beobachtet. Er beschrieb die typischen Gefäßproliferationen,
welche histologisch der Verruga peruana sehr ähnlich sind,
und hat mittels Warthin-Starry-Silberfärbung die Erreger
im Gewebe nachgewiesen. Klinisch manifestiert sich die BA mit
Fieber (93%), niedriger CD4-Lymphozytenzahl, kutanen oder subkutanen
Läsionen (55%), Lymphadenopathie (76%), Hepatomegalie (50%)
und Splenomegalie (33%) [140]. Die Hautveränderungen im
Rahmen der BA sind im Allgemeinen schmerzlos, es besteht kein
Juckreiz, ihre Anzahl reicht von Einzelläsionen bis zu
mehreren hundert Effloreszenzen. Es werden vier unterschiedliche
Typen beobachtet: subkutane, teils verschiebliche, teils verbackene
Tumore; exophytisch wachsende, rötliche, häufig zentral
ulzerierte und verkrustete, bei Traumatisierung leicht blutende
Knoten; dermale, meist derbe, livid-rötliche Infiltrate
und gelegentlich über osteolytischen Herden trockene hyperkeratotische
erythematöse psoriasiforme Plaques [125] (Abb. 2a, 2b).
Zusätzlich zur Haut können auch die Schleimhäute
des Gastrointestinaltraktes, des Urogenitaltraktes und des Respirationstraktes
befallen sein. Die viszerale Form der BA mit Gefäßproliferationen
und zystischen Blutansammlungen in der Leber und häufig
auch der Milz ist als Peliosis hepatis bekannt.
Die Erkrankung tritt überwiegend bei immunsupprimierten,
HIV-positiven Patienten auf, wird gelegentlich auch bei Patienten
mit Organtransplantationen und selten auch bei Immunkompetenten
beobachtet.
| Abbildung
2a: Bazilläre Angiomatose (aus 125) |
Abbildung
2b: Bazilläre Angiomatose (aus 125) |
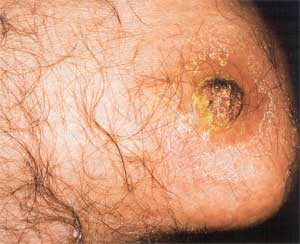 |
 |
Ätiologisch
sind B. henselae und B. quintana in gleicher
Häufigkeit bei diesen Erkrankungen zu finden. In einer
Studie von Koehler et al. [141] waren 53% der Infektionen durch
B. henselae und 47% durch B. quintana verursacht,
wobei die Haut in fast allen Fällen betroffen war. Lymphknoten-,
Leber- und Milz-Befall waren wesentlich häufiger mit B.
henselae assoziiert, Knochenläsionen und subkutane
Knoten hingegen wurden überwiegend bei B. quintana-Infektionen
beobachtet. Eine Erregerisolierung gelingt am besten aus der
Blutkultur [141, 142, 143]. Die meisten Diagnosen werden jedoch
wegen der bereits erwähnten Kulturschwierigkeiten histologisch
oder molekularbiologisch gestellt. Auch die Serologie ist bei
diesen immunsupprimierten Patienten nicht diagnoseweisend, da
nur selten (14%) Antikörper nachgewiesen werden können
[142]. Therapeutisch zeigen Makrolide und Doxycyclin die besten
Erfolge, Rezidive werden jedoch trotz adäquater Therapie
beobachtet.
Die Bartonella-Endokarditis
wird in letzter Zeit immer häufiger beobachtet. B.
henselae und B. quintana kommen gleichermaßen
als Erreger in Betracht [144]. 1993 erschienen erstmals drei
Fallberichte über eine Endokarditis durch B. henselae,
B. elizabethae und B. quintana [41, 145, 146].
Inzwischen sind in der Literatur bei überwiegend alkoholabhängigen
und obdachlosen Patienten mehr als 50 Fälle von Bartonella-bedingten
Endokarditiden beschrieben. Eine B. henselae-Endokarditis
wird häufig bei vorgeschädigten Klappen und Katzenexposition
gefunden, während eine Endokarditis durch B. quintana
überwiegend bei obdachlosen Patienten mit Kleiderlausbefall
diagnostiziert wird.
Etwa 5-14%
aller Endokarditiden bleiben kulturell negativ. Besonders in
diesen Fällen müssen die schwer kultivierbaren Bartonellen
in der Ätiologie verstärkt berücksichtigt werden.
Diagnoseweisend kann der Nachweis von oft außergewöhnlich
hohen Bartonella-Antikörper-Titern sein. Die Anzucht der
Erreger aus Blutkulturen ist sehr schwierig und wird durch eine
oft bereits laufende Antibiotika-Therapie erschwert. Nicht selten
wird ein Klappenersatz erforderlich, und in den meisten bisher
bekannten Fällen wurde die Diagnose molekularbiologisch
aus dem operativ entfernten Klappenmaterial gestellt.
|
| Diagnostik
von Bartonella-Infektionen
Die Katzenkratzkrankheit
wurde schon bald nach ihrer Erstbeschreibung als infektiöses
Geschehen erkannt, und mit dem Eiter aus befallenen Lymphknoten
konnte bei den entsprechenden Patienten ein positiver Hauttest
hervorgerufen werden. So entwickelten Hanger und Rose schon
1946 den nach ihnen benannten Hauttest. In Unkenntnis des Erregers
war die KKK lange Zeit eine Ausschlussdiagnose, welche dann
gestellt wurde, wenn mindestens drei der folgenden vier Kriterien
erfüllt waren: 1. Katzenkontakt mit anschließender
Primärläsion durch Beißen oder Kratzen, 2. ein
positiver Hauttest, 3. regionale Lymphknotenschwellungen mit
Ausschluss aller bekannten in Betracht kommenden Erreger, und
4. charakteristische histopathologische Lymphknotenveränderungen
[115, 147]. Inzwischen wurden zuverlässige serologische
und molekularbiologische Nachweismethoden etabliert, sodass
auf den umstrittenen Hauttest heute völlig verzichtet werden
soll.
Über
den möglichen Erreger der KKK wurde in der Vergangenheit
viel spekuliert. Besonders Chlamydien, Mykoplasmen, Herpesviren
und atypische Mykobakterien, aber auch Pasteurella
und Rothia dentocariosa wurden ursächlich mit
der Erkrankung in Zusammenhang gebracht [148]. 1983 entdeckten
Wear et al. [149] mit der Warthin-Starry-Silberfärbung
in Lymphknoten von Patienten mit KKK feine, pleomorphe Stäbchen,
welche sich in der modifizierten Braun-Hopp Gewebe-Gram-Färbung
gramnegativ darstellten. Mit der Isolierung und Identifizierung
eines bis dahin unbekannten Bakteriums aus Lymphknotengewebe
von Patienten mit KKK, genannt Afipia felis, glaubte
man 1988 nun endlich den eigentlichen Erreger der KKK gefunden
zu haben [150]. Diese Hypothese kam jedoch recht schnell ins
Wanken. 1992 wurde aus Blutkulturen von gesunden Katzen ein
neuer Erreger, Bartonella henselae, isoliert [44].
Serologische Untersuchungen an Patienten mit KKK zeigten zu
einem hohen Prozentsatz (88%) Antikörper gegen B. henselae,
während es in der Kontrollgruppe nur 6% waren [151]. Bei
den gleichen Patienten wurden keinerlei Antikörper gegen
Afipia felis gefunden, und mittels molekularbiologischer
Untersuchungen wurde
B. henselae-DNA, jedoch keine Afipia felis-DNA
in dem für den Hauttest eingesetzten Antigen nachgewiesen
[152]. 1993 konnte B. henselae erstmals aus dem Lymphknoten
eines Patienten mit Katzenkratzkrankheit auf Agarnährböden
angezüchtet werden [116]. Zahlreiche weitere serologische
[153, 127, 154, 155, 156, 157] und molekularbiologische [158,
159, 160] Arbeiten bestätigten in der Folgezeit B.
henselae und nicht Afipia felis als den Erreger
der KKK.
Serologische Nachweismethoden
Die Serologie ist sicherlich die schnellste und bisher am besten
etablierte diagnostische Methode zum Nachweis einer KKK. Antikörper
gegen B. henselae werden mittels indirekter Immunfluoreszenz,
ELISA oder Westernblot nachgewiesen. Der Immunfluoreszenztest
scheint bisher die zuverlässigsten Ergebnisse zu liefern,
mit einer Sensitivität von 98 bis 100% und einer Spezifität
von 60 bis 98% [118, 127, 153, 154, 155, 156, 157, 161]. IgG-Antikörper
(selten auch IgM-Antikörper) sind meist schon zum Zeitpunkt
der Lymphknotenschwellung nachweisbar. Diagnoseweisend sind
Antikörper-Titer von 1:512 oder höher. Niedrigere
Titer von 1:64 bis 1:256 werden auch bei ca. 30% der gesunden
Erwachsenen nachgewiesen, sie können jedoch auch Ausdruck
einer beginnenden oder abgelaufenen Katzenkratzkrankheit sein.
In solchen Fällen sind serologische Verlaufskontrollen
zur Klärung der Diagnose erforderlich. Kreuzreaktionen
zwischen B. henselae und B. quintana treten
in bis zu 95% der Fälle auf [156]. Die Katzenkratzkrankheit
wird jedoch nur mit B. henselae und neuerdings auch
mit B. clarridgeiae ursächlich in Zusammenhang
gebracht.
Während
in den USA Antikörper bei negativen Kontrollkollektiven
nur in 4-6% der untersuchten Fälle gefunden wurden, scheint
die Durchseuchung in Europa sehr viel höher zu sein. Nadal
et al. [161] fanden bei gesunden Blutspendern aus der Schweiz
Antikörper gegen B. henselae in 26 bis 60%, je
nach städtischer oder ländlicher Herkunft der Probanden.
In Deutschland wurde eine Durchseuchung von rund 30% bei gesunden
Erwachsenen unabhängig von einer aktuellen Katzenexposition
nachgewiesen [156, 162].
Antikörper
gegen B. clarridgeiae konnten kürzlich bei 3,9%
der Patienten mit Lymphknotenschwellungen nachgewiesen werden,
jedoch nicht in der Kontrollgruppe [163].
Anfangs
wurde eine lebenslange Immunität nach durchgemachter Katzenkratzkrankheit
diskutiert. Erste serologische Verlaufskontrollen zeigen jedoch,
dass die Antikörper schon innerhalb weniger Monate oder
nach einem Jahr unter die Nachweisgrenze absinken können.
Kulturelle
Nachweisverfahren
Der kulturelle Nachweis des Erregers aus Abstrichen, Lymphknoten
oder aus Lysis-Zentrifugations- oder Bactec®-Blutkulturen
ist zwar erstrebenswert, durch das langsame Wachstum von B.
henselae jedoch sehr zeitaufwändig und für die
routinemäßige Diagnostik sehr unzuverlässig.
Bartonella henselae wächst am besten auf bluthaltigen
Nährmedien bei 37°C in 5% CO2-Atmosphäre [39,
20, 143, 164, 165]. Durchschnittlich nach 1-3 Wochen Bebrütung
erscheinen anfangs oft raue, im Agar fest haftende, kleine Kolonien,
welche nach mehreren Passagen in ein cremiges Wachstum übergehen
(Abb. 3). Mittels typischer biochemischer Reaktionen, der Gesamtzellfettsäurenanalyse
oder der PCR-Amplifikation und Sequenzierung können die
Bakterien identifiziert werden [20, 39, 65, 77, 116]. Die meisten
humanen Bartonella-Isolate wurden bisher aus Blutkulturen oder
Gewebebiopsien von Immunsupprimierten oder HIV-positiven Patienten
mit BA oder Endokarditis isoliert. Nur selten gelang die Anzüchtung
der Erreger bei immunkompetenten Patienten mit KKK.
Abbildung
3: Mischkultur von B. henselae (kleine
Kolonien) und B. clarridgeiae (große raue
Kolonien) |
|
Molekularbiologische
Nachweismethoden
Eine schnelle und spezifische Nachweismethode für B.
henselae ist die PCR. Der DNA-Nachweis des Erregers durch
PCR-Amplifikation mit anschließender Sequenzierung oder
Hybridisierung kann aus frischen oder formalinfixierten Gewebebiopsien
durchgeführt werden [158, 160, 166, 167, 168, 169]. Frisches
oder tiefgefrorenes Material (Biopsien, Aspirate, Abstriche)
ist für diese Untersuchung bestens geeignet, während
bei formalinfixiertem Gewebe falsch negative Ergebnisse auftreten
können. Bei Patienten mit systemischen Symptomen kann eine
PCR auch aus EDTA-Blut durchgeführt werden. Die PCR ist
wesentlich sensitiver als die Kultur, aber bisher nicht in allen
Labors etabliert. Bei sachgemäß behandeltem Probenmaterial
ist die Sensitivität der PCR innerhalb der ersten beiden
Monate nach Erkrankungsbeginn sehr hoch, fällt jedoch ab
dem 3. Erkrankungsmonat deutlich ab [129].
Histopathologie
Histologisch können bei der Katzenkratzkrankheit drei Entwicklungsstadien
unterschieden werden. Initial werden eine Hyperplasie der Keimzentren
sowie epitheloidzellige Granulome mit häufigem Nachweis
von Langhans’schen Riesenzellen beobachtet. Während
des zweiten Stadiums nimmt die Zahl der Granulome weiter zu,
sie fusionieren miteinander und werden von polymorphkernigen
Leukozyten infiltriert [128]. Es bilden sich zentrale Nekrosen
mit progressiver Einschmelzung. Im dritten Stadium finden sich
zahlreiche eitergefüllte Sinus, und durch eine Kapselruptur
kann sich der Eiter in das umliegende Gewebe entleeren [170].
Sonographisch können beginnende Einschmelzungen erkannt
und durch Punktion entlastet werden. Gelegentlich sind die Bakterien
in der Warthin-Starry-Silberfärbung nachweisbar. Immunhistochemische
Nachweismethoden sind beschrieben, bleiben jedoch zur Zeit nur
einzelnen Speziallabors vorbehalten. Histopathologisch kann
die KKK nicht immer von einer Tuberkulose unterschieden werden.
In solchen Fällen kann der Einsatz molekularbiologischer
und serologischer Methoden sehr hilfreich sein.
|
| Therapie
von Bartonella-Infektionen
Obwohl
die meisten Spezies in vitro gegen fast alle Antibiotika
sehr empfindlich sind, ist die Therapie einer Bartonella-Infektion
oft sehr unbefriedigend. Daten aus kontrollierten Studien fehlen
fast vollständig. Penicilline und Cephalosporine haben
sich trotz In-vitro-Sensibilität als unwirksam
erwiesen, Chinolone und Trimethoprim-Sulfamethoxazol wurden
mit unterschiedlichem Erfolg eingesetzt. Als Mittel der Wahl
werden für B. henselae- und B. quintana-Infektionen
Makrolide, alternativ Doxycyclin oder Rifampicin empfohlen.
Carrión-Krankheit
Unbehandelt hat das Oroya-Fieber mit 40-88% eine der höchsten
Letalitätsraten aller Infektionskrankheiten. Therapeutisches
Mittel der Wahl in der Akutphase ist Chloramphenicol, alternativ
auch Tetracyclin und neuerdings auch Erythromycin, was bei rechtzeitigem
Einsatz zu einem schnellen Fieberabfall innerhalb von 48 h führt
[1]. Eine Bakteriämie kann jedoch für längere
Zeit bestehen, und die Gabe von Chloramphenicol kann das anschließende
Auftreten einer Verruga peruana nicht zuverlässig verhindern
[171]. Doch auch unter dieser Therapie liegt die Letalität
noch bei 8% [2].
Zur Behandlung
der verrukösen Form werden Streptomycin, Rifampicin oder
Tetracyclin eingesetzt. Die Wirksamkeit dieser Chemotherapeutika
ist jedoch nicht gesichert, zumal bei einer Verruga peruana
mit einer Spontanheilung innerhalb von einigen Monaten zu rechnen
ist.
Fünftagefieber
Das Fünftagefieber zeigte in der Vergangenheit nach mehreren
Fieberschüben eine hohe Spontanheilungsrate, wurde jedoch
auch mit Chloramphenicol oder Tetracyclin therapiert.
Katzenkratzkrankheit
Die Therapie der Katzenkratzkrankheit hängt entscheidend
von dem Schweregrad der Erkrankung ab. Bei der typischen KKK
bei immunkompetenten Patienten wird eine Antibiotika-Therapie
nicht empfohlen. Die Erkrankung ist selbstlimitierend und bildet
sich innerhalb von 2 bis 4 bis 6 Monaten (im Einzelfall auch
länger) mit und ohne Antibiose spontan zurück. Bisher
liegt eine einzige prospektiv randomisierte, doppelt-blinde,
Placebo-kontrollierte Studie zur Therapie der KKK vor [172].
Die orale Gabe von Azithromycin (500 mg Tag 1 und 250 mg Tag
2-5) zeigte bei der Hälfte der Patienten (7/14) einen positiven
Effekt auf die Rückbildung der Lymphknotenschwellungen
innerhalb der ersten 4 Wochen. Jedoch sind auch unter dieser
Therapie bei einzelnen Patienten neue Lymphknotenschwellungen
dazugekommen oder haben bestehende weiter an Größe
zugenommen. Nach 4 Monaten hatten sich die Lymphknotenschwellungen
sowohl in der Placebo-kontrollierten als auch in der Azithromycin-therapierten
Gruppe weitgehend zurückgebildet.
Bei einem
atypischen Verlauf der KKK wird eine Therapie mit Makroliden,
Doxycyclin oder Rifampicin empfohlen. Spontanheilungen werden
auch hier beobachtet, Daten aus kontrollierten Therapiestudien
liegen bisher nicht vor.
Bazilläre Angiomatose / Peliose
Die Bazilläre Angiomatose / Peliose tritt überwiegend
bei immunsupprimierten, HIV-positiven Patienten auf und wird
in gleichem Maße von B. henselae und B. quintana
hervorgerufen. Eine Therapie mit Makroliden oder Doxycyclin,
evtl. auch in Kombination mit Gentamicin oder Rifampicin, ist
bei diesen Patienten absolut indiziert. Entscheidend ist hier
auch die Dauer der Therapie: Je nach klinischem Verlauf sollte
eine Therapie-Dauer von 2 (bis 4) Monaten nicht unterschritten
werden. In der Regel sprechen die Hautveränderungen bei
der BA auf eine Therapie mit Erythromycin (oder einem anderen
Makrolid) sehr gut an, Rezidive sind jedoch trotz adäquat
erfolgter Therapie bekannt.
|
Literatur:
| 1.
Llanos-Cuentas E.A., Warrell D.A.: „Bartonellose.“
In: D.A. Warrell (Ed.): Infektionskrankheiten. Edition Medizin
(1990) 461-463. |
| 2.
Garcia-Caceres U., Garcia F.U.: „Bartonellosis. An
immunodepressiv disease and the life of Daniel Alcides Carrión.“
Am. J. Clin. Pathol. 95 (Suppl.1) (1991) 58-66. |
| 3.
de Estete M.: „Relacion del viaje de Hernando Pizarro
(1553) as cited by Hermilio Valdizán in Apuntes para
la Historia de la verruga peruana.“ Anal. Fac. Med.
Lima 10 (Suppl) (1925) 34-44. |
| 4.
Allison M.J., Pezzia A., Gerszten E., Mendoza D.: „A
case of Carrión’s disease associated with human
sacrifice from the Huari culture of southern Peru.“
Am. J. Phys. Anthropol. 41 (1985) 295-300. |
| 5.
Manguina C.: „Estudio de 23 casos de bartonellosis
humana en San Marcos.“ Ancah. Diagnóstico 7
(6) (1981) 257-266. |
| 6.
Manguina C., Pérez E.: „La enfermedad de Carrión
y leishmaniasis andina en la región de Conchucos,
distrito de Chvin, San Marcos y Huantar, procinia de Huari,
departamento de Ancash.“ Diagnóstico 16 (1)
(1985) 5-12. |
| 7.
Ellis B.A., Rotz L.D., Leake J.A., Samalvides F., Bernable
J., Ventura G., Padilla C., Villaseca P., Beati L., Regnery
R., Childs J.E., Olson J.G., Carillo C.P.: „An outbreak
of acute bartonellosis (Oroya fever) in the Urubamba region
in Peru, 1998.“ Am. J. Trop. Med. Hyg. 61 (1999) 344-349. |
| 8.
Werner H., Haenssler E.: „Über Fünftagefieber,
febris quintana.“ Münch. Med. Wochenschrift 63
(1916) 1020-1023. |
| 9.
Kostrzewski J.: „The epidemiology of trench fever.“
Bull. Acad. Pol. Sci. (Med.) 7 (1949) 233-263. |
| 10.
Munk F., da Rocha-Lima H.: „Klinik und Ätiologie
des sogen. "Wolhynischen Fiebers". (Werner-His’sche
Krankheit) I. Klinischer Teil.“ Münch. Med. Wochenschrift
64 (42) (1917) 1357-1361. |
| 11.
Werner H., Benzler F., Wiese O.: „Zur Ätiologie
des Fünftagefiebers.“ Münch. Med. Wochenschrift
63 (1916) 1359-1370. |
| 12.
Thörner W.: „Zur Kenntnis des Fünftagefiebers.
(Febris quintana, Febris wolhynica).“ Münch.
Med. Wochenschrift 63 (1916) 1775-1776. |
| 13.
Logan J.S.: „Trench fever in Belfast and the nature
of the relapsing fevers in the United Kingdom in the nineteenth
century.“ Ulst. Med. J. 58 (1989) 83-88. |
| 14.
Swift H.F.: „Trench fever.“ Ann. Intern. Med.
26 (1920) 76-98. |
| 15.
Maurin M., Raoult D.: „Bartonella (Rochalimaea) quintana-Infections.“
Clin. Microbiol. Reviews. 9 (1996) 273-292. |
| 16.
Raoult D., Ndihokubwayo J.B., Tissot-Dupont H., Roux V.,
Faugere B., Abegbinni R., Birtles R.J.: „Outbreak
of epidemic typhus associated with trench fever in Burundi.“
The Lancet 352 (1998) 353-358. |
| 17.
Munk F., da Rocha-Lima H.: „Klinik und Ätiologie
des sogen. "Wolhynischen Fiebers". (Werner-His’sche
Krankheit). II. Ergebnis der ätiologischen Untersuchung
und deren Beziehung zur Fleckfieberforschung.“ Münch.
Med. Wochenschrift 64 (44) (1917) 1422-1426. |
| 18.
de Cerqueira Falcao E. (Hrsg.) Prof. Dr. H. Da Rocha Lima:
„Estudos sobre o tifo exantemático.“
Sao Paulo, Brasil (1966) 573-581. |
| 19.
Birtles R.J., Harrison T.G., Saunders N.A., Molyneux D.H.:
„Proposals to unify the genera Grahamella and Bartonella,
with descriptions of Bartonella talpae comb. nov., Bartonella
peromysci comb. nov., and three new species, Bartonella
grahammii sp. nov., Bartonella taylorii sp. nov., and Bartonella
doshiae sp. nov.“ Int. J. Syst. Bacteriol. 45 (1995)
1-8. |
| 20.
Sander A.: „Microbiological Diagnosis of Bartonella
Species and Afipia felis.“ In: Schmidt A. (ed): „Bartonella
and Afipia Species Emphasizing Bartonella henselae.“
Contrib. Microbiol. Basel, Karger, vol 1 (1998) 98-112. |
| 21.
Welch D.F., Slater L.N.: „Bartonella.“ in Murray
PR (ed): „Manual of Clinical Microbiology.“
ASM Press, Washington, D.C., 6th edition (1995) 690-695. |
| 22.
Wong M.T., Thornton D.C., Kennedy R.C., Dolan M.J.: „A
chemically defined liquid medium that supports primary isolation
of Rochalimaea (Bartonella) henselae from blood and tissue
specimens.“ J. Clin. Microbiol. 33 (1995) 742-744. |
| 23.
Brenner D.J., O'Connor S.P.,Winkler H.H., Steigerwalt A.G.:
„Proposals to unify the genera Bartonella and Rochalimaea,
with descriptions of Bartonella quintana comb. nov., Bartonella
vinsonii comb. nov., Bartonella henselae comb. nov., and
Bartonella elizabethae comb. nov., and to remove the family
Bartonellaceae from the order Rickettsiales.“ Intern.
J. Syst. Bacteriol. 43 (1993) 777-786. |
| 24.
Kordick D.L., Swaminathan B., Greene C.E., Wilson K.H.,
Whitney A.M., O’Connor S., Hollis D.G., Matar G.M.,
Steigerwalt A.G., Malcolm G.B., Hayes P.S., Hadfield T.L.,
Breitschwerdt E.B., Brenner D.J.: „Bartonella vinsonii
subsp. berkhoffii subsp. nov., isolated from dogs; Bartonella
vinsonii subsp. vinsonii; and emended description of Bartonella
vinsonii.“ Int. J. Syst. Bacteriol. 46 (1996) 704-709. |
| 25.
Pappalardo B.L., Correa M.T., York C.C., Peat C.Y., Breitschwerdt
E.B.: „Epidemiologic evaluation of the risk factors
associated with exposure and seroreactivity to Bartonella
vinsonii in dogs.“ Am. J. Vet. Res. 58 (1997) 467-471. |
| 26.
Lawson P.A., Collins M.D.: „Description of Bartonella
clarridgeiae sp. nov. isolated from the cat of a patient
with Bartonella henselae septicemia.“ Med. Microbiol.
Lett. 5 (1996) 64-73. |
| 27.
Heller R., Kubina M., Mariet P., Riegel P., Delacour G.,
Dehio C., Lamarque F., Kasten R., Boulouis H-J., Monteil
H., Chomel B., Piemont Y.: „Bartonella alsatica sp.
nov., a new Bartonella species isolated from the blood of
wild rabbits.“ Int. J. Syst. Bacteriol. 49 (1999)
283-288. |
| 28.
Heller R., Riegel Ph., Hausmann Y., Delacour G., Bermond
D., Dehio C., Lamarque F., Monteil H., Chomel B., Piemont
Y.: „Bartonella tribocorum sp. nov., a new Bartonella
species isolated from the blood of wild rats.“ Int.
J. Syst. Bacteriol. 48 (1998) 1333-1339. |
| 29.
Droz S., Chi B., Horn E., Steigerwalt A.G., Whitney A.M.,
Brenner D.J.: „Bartonella koehlerae sp. nov., isolated
from cats.“ J. Clin. Microbiol. 37 (1999) 1117-1122. |
| 30.
Welch D.F., Carroll K.C., Hofmeister E.K., Persing D.H.,
Robinson D.A., Steigerwalt A.G., Brenner D.J.: „Isolation
of a new subspecies, Bartonella vinsonii subsp. arupensis,
from a cattle rancher: identity with isolates found in conjunction
with borrelia burgdorferi and babesia microti among naturally
infected mice.“ J. Clin. Microbiol. 37 (1999) 2598-2601. |
| 31.
Dehio C., Lanz C., Pohl R., Behrens P., Bermond D., Piemont
Y., Pelz K., Sander A.: „Description of a new Bartonella
species, Bartonella schoenbuchii sp. nov., isolated from
blood of wild roe deer.“ Int. J. Syst. Evol. Bacteriol.
51 (2001) 1557-1565. |
| 32.
Bermond D., Boulouis H.J., Heller R., van Laere G., Dehio
C., Monteil H., Chomel B.B., Sander A., Piemont Y.: „Bartonella
bovis Bermond et al. sp. nov. and Bartonella capreoli sp.
nov., isolated from European ruminants.“ Int. J. Syst.
Evol. Bacteriol. 52 (2002) 383-390. |
| 33.
Dehio C., Sander A.: „Bartonella as Emerging Pathogens.“
Trends Microbiol. 7 (1999) 226-228. |
| 34.
Barton A.L.: „Cuerpos endoglobulares en la sangre
verrucosa.“ Gaceta de los Hospitales 18 (1905) 35-39. |
| 35.
Brumpt E.: „Note sur le parasite des hematies de la
taupe: Grahamella talpae n.g. n.sp.“ Bull. soc. Pathol.
Exot. 4 (1911) 514-517. |
| 36.
Schmincke R.A.: „Histopathologischer Befund in Roseolen
der Haut bei Wolhynischem Fieber.“ Münch. Med.
Wochenschrift 64 (1917) 961. |
| 37.
Tyzzer E.E.: „A comparison study of Grahamellae, Haemobartonellae
and Eperythrozoa in small mammals.“ Proc. Am. Phil.
Soc. 85 (1942) 359-398. |
| 38.
Baker J.A.: „A rickettsial infection in Canadian voles.“
J. Exp. Med. 84 (1946) 37-50. |
| 39.
Regnery R.L., Anderson B.E., Clarridge J.E., Rodriguez-Barradas
M.C., Jones D.C., Carr J.H.: „Characterization of
a novel Rochalimaea species, R. henselae sp. nov., isolated
from blood of a febrile, human immunodeficienty virus-positive
patient.“ J. Clin. Microbiol. 30 (1992) 265-274. |
| 40.
Welch D.F., Pickett D.A., Slater L.N., Steigerwalt A.G.,
Brenner D.J.: „Rochalimaea henselae sp. nov., a cause
of septicemia, bacillary angiomatosis, and parenchymal bacillary
peliosis.“ J. Clin. Microbiol. 30 (1992) 275-280. |
| 41.
Daly J.S., Worthington M.G., Brenner D.J., Moss C.W., Hollis
D.G., Weyant R.S., Steigerwalt A.G., Weaver R.E., Daneshvar
M.I., O’Connor S.P.: „Rochalimaea elizabethae
sp. nov. isolated from a patient with endocarditis.“
J. Clin. Microbiol. 31 (1993) 872-881. |
| 42.
Bermond D., Heller R., Barrat F., Delacour G., Dehio C.,
Alliot A., Monteil H., Chomel B., Boulouis H-J., Piemont
Y.: „Bartonella birtlesii sp. nov., isolated from
small mammals (Apodemus spp.).“ Int. J. Syst. Evol.
Bacteriol. 50 (2000) 1973-1979. |
| 43.
Kosoy M., Murray M., Bilmore R.E. Jr., Bai Y., Gage K.L.:
„Bartonella strains from ground squirrels are identical
to Bartonella washoensis isolated from a human patient.“
J. Clin. Microbiol. 41 (2003) 645-50. |
| 44.
Regnery R., Martin M., Olson J.: „Naturally occuring
Rochalimaea henselae-infection in domestic cats.“
The Lancet 340 (1992) 557-558. |
| 45.
Sander A., Bühler C., Pelz K., von Cramm E., Bredt
W.: „Detection and identification of two Bartonella
henselae variants in domestic cats in Germany.“ J.
Clin. Microbiol. 35 (1997) 584-587. |
| 46.
Allerberger F., Schönbauer M., Regnery R.L., Dierich
M.: „Prävalenz von Rochalimaea henselae-Antikörpern
bei Katzen in Österreich.“ Wien. Tierärztl.
Mschr. 82 (1995) 40-43. |
| 47.
Chomel B.B., Kasten R.W., Floyed-Hawkins K., Chi-Yamamoto
B., Roberts-Wilson J., Gurfield A.N., Abbott R.C., Pedersen
N.C., Koehler J.E.: „Experimental transmission of
Bartonella henselae by the cat flea.“ J. Clin. Microbiol.
34 (1996) 1952-1956. |
| 48.
Koehler J.E., Glaser C.A., Tappero J.W.: „Rochalimaea
henselae infection. A new zoonosis with the domestic cat
as a reservoir.“ JAMA 271 (1994) 531-535. |
| 49.
Jameson P., Greene C., Regnery R., Dryden M., Marks A.,
Brown J., Cooper J., Glaus B., Greene R.: „Prevalence
of Bartonella henselae antibodies in pet cats throughout
regions of North America.“ J. Infect. Dis. 172 (1995)
1145-1149. |
| 50.
Maruyama, S., Tanaka S., Sakai T., Katsube Y.: „Prevalence
of Bartonella species among pet cats in Japan. Abstract.
1st International Conference on Bartonella as Emerging Pathogens.“
Tübingen, Germany. March 5-7, 1999. J. Microbiol. Methods
(1999) 284-285. |
| 51.
Arvand M., Klose A.J., Schwarz-Porsche D., Hahn H., Wendt
C.: „Genetic variability and Prevalence of Bartonella
henselae in cats in Berlin, Germany, and analysis of its
genetic relatedness to a strain from Berlin that is pathogenic
to humans.“ J. Clin. Microbiol. 39 (2001) 743-746. |
| 52.
Kordick D.L., Breitschwerdt E.B.: „Persistent infection
of pets within a household with three Bartonella species.“
Emerg. Infect. Dis. 4 (1998) 325-328. |
| 53.
Heller R., Artois M., Xémar V., De Briel D., Géhin
H., Jaulhac B., Monteil H., Piémont Y.: „Prevalence
of Bartonella henselae and Bartonella clarridgeiae in stray
cats.“ J. Clin. Microbiol. 35 (1997) 1327-1331. |
| 54.
Chomel B.B., Carlos E.T., Kasten R.W., Yamamoto K., Chang
C-C., Carlos R.S., Abenes M.V., Pajares C.M.: „Bartonella
henselae and Bartonella clarridgeiae infection in domestic
cats from the Philippines.“ Am. J. Trop. Med. Hyg.
60 (1999) 593-597. |
| 55.
Marston E.L., Finkel B., Regnery R.L., Winoto I.L., Ross
Graham R., Wignal S., Simanjuntak G., Olson J.O.: „Prevalence
of Bartonella henselae and Bartonella clarridgeiae in an
urban Indonesian cat population.“ Clin. Diagn. Lab.
Immunol. 6 (1999) 41-44. |
| 56.
Gurfield N., Boulouis H.J., Chomel B., Heller R., Larsen
R.W., Yamamoto K., Piemont Y.: „Coinfection by Bartonella
clarridgeiae and Bartonella henselae and different Bartonella
henselae strains in domestic cats.“ J. Clin. Microbiol.
35 (1997) 2110-2113. |
| 57.
Bergmans A.M.C., de Jong D.M.A., van Amerongen G., Schot
C.S., Schouls L.M.: „Prevalence of Bartonella species
in domestic cats in the Netherlands.“ J. Clin. Microbiol.
35 (1997) 2256-2261. |
| 58.
Heller R., Bermond D., Delacour G., Boulouis H.J., Chomel
B., Piemont Y.: „Distribution of Bartonella in European
wild mammals. 1st International Conference on Bartonella
as Emerging Pathogens.“ Tübingen, Germany. March
5-7, 1999. J. Microbiol. Methods (1999) 279-280. |
| 59.
Chomel B.B., Kasten R.W., Yamamoto K., Chang C., Honadel
T.E., Kikuchi Y.: „Epidemiology of Bartonella infections
in domestic and wild carnivores and ruminants. 1st International
Conference on Bartonella as Emerging Pathogens.“ Tübingen,
Germany. March 5-7, 1999. J. Microbiol. Methods (1999) 280-281. |
| 60.
Kosoy M.Y., Regnery R.L., Kosaya O.I., Jones D.C., Marston
E.L., Childs J.E.: „Isolation of Bartonella spp. from
embryos and neonates of naturally infected rodents.“
J. Wildlife Diseases 34 (1998) 305-309. |
| 61.
Schouls L.M., van de Pol I., Rijpkema S.G.T., Schot C.S.:
„Detection and identification of Ehrlichia, Borrelia
burgdorferi sensu lato, and Bartonella species in Dutch
Ixodes ricinus Ticks.“ J. Clin. Microbiol. 37 (1999)
2215-2222. |
| 62.
Eskow E., Rao R.V., Mordechai E.: „Concurrent infection
of the central nervous system by Borrelia burgdorferi and
Bartonella henselae: evidence for a novel tick-borne disease
complex.“ Arch. Neurol. 58 (2001) 1357-63. |
| 63.
Sanogo Y.O., Zeaiter Z., Caruso G., Merola F., Shpynow S.,
Brouqui P., Raoult D.: „Bartonella henselae in Ixodes
ricinus ticks (Acari: Ixodida) removed from humans, Belluno
province, Italy.“ Emerg. Infect. Dis. 9 (2003) 329-332. |
| 64.
Yamamoto K., Chomel B.B., Lowenstine L.J., Kikuchi Y., Phillips
L.G., Barr B.C., Swift P.K., Jones K.R., Riley S.P.D., Kasten
R.W., Foley J.E., Pedersen N.C.: „Bartonella henselae
antibody prevalence in free-ranging and captive wild felids
from California.“ J. Wildlife Diseases 34 (1998) 56-63. |
| 65.
Sander A.: „Bartonellosis.“ In: Cimolai N. (ed):
„Laboratory Diagnosis of Bacterial Infections.“
New York, Marcel Decker (2001) 653-686. |
| 66.
Kordick D.L., Wilson K.H., Sexton D.J., Hadfield T.L., Berkhoff
H.A., Breitschwerdt E.B.: „Prolonged Bartonella bacteremia
in cats associated with cat-scratch disease patients.“
J. Clin. Microbiol. 33 (1995) 3245-3251. |
| 67.
Chomel B.B., Abbott R.C., Kasten R.W., Floyd-Hawkins K.A.,
Kass P.H., Glaser C.A., Pedersen N.C., Koehler J.E.: „Bartonella
henselae prevalence in domestic cats in California: Risk
factors and association between bacteremia and antibody
titers.“ J. Clin. Microbiol. 33 (1995) 2445-2450. |
| 68.
Maruyama S., Nogami S., Inoue I., Naamba S., Asanome K.,
Katsube Y.: „Isolation of Bartonella henselae from
domestic cats in Japan.“ J. Vet. Med. Sci. 58 (1996)
81-83. |
| 69.
Branley J., Wolfson C., Waters P., Gottlieb T., Bradbury
R.: „Prevalence of Bartonella henselae bacteremia,
the causative agent of cat scratch disaese, in an Australian
cat population.“ Pathology 28 (1996) 262-265. |
| 70.
Kelly P.J., Rooney J.J.A., Marston E.L., Jones D.C., Regnery
R.L.: „Bartonella henselae isolated from cats in Zimbabwe.“
The Lancet 351 (1998) 1706. |
| 71.
Birtles R.J., Laycock G., Kenny M.J., Shaw S.E., Day M.J.:
„Prevalence of Bartonella species causing bacteremia
in domesticated and companion animals in the United Kingdom.“
Vet. Rec. 151 (2002) 225-229. |
| 72.
Cabassi C.S, Farnetti E., Casali B., Taddei S., Donofrio
G., Galvani G., Cavirani S.: „Isolation of Bartonella
henselae from domestic cats in an Italian urban area.“
Microbiologica 25 (2002) 253-257. |
| 73.
Bergh K., Bevanger L., Hanssen I., Loseth K.: „Low
prevalence of Bartonella henselae infections in Norwegian
domestic and feral cats.“ APMIS 110 (2002) 309-314. |
| 74.
O’Halloran H.S., Draud K., Minix M., Rivard A.K.,
Pearson P.A.: „Leber’s Neuroretinitis in a patient
with serologic evidence of Bartonella elizabethae.“
Retina 18 (1998) 276-278. |
| 75.
Birtles R.J., Canales J., Alvarez E., Guerra H., Llanos-Cuentas
A., Raoult D., Doshi N., Harrison T.G.: „Survey of
Bartonella species infecting intradomicillary animals in
the Huayllacallan valley Ancash, Peru, a region of endemic
for human bartonellosis.“ Am. J. Trop. Med. Hyg. 60
(1999) 799-805. |
| 76.
Ellis B., Regnery R., Marston E., Jones D., Olsen J., Glass
G.E., Childs J.E.: „Recovery and characterisation
of Bartonella from the genus Rattus.“ 13th Sesqui-Annual
Meeting of the American Society for Rickettsiology, Seven
Springs, Pa, abstr. 21, Sept. 1997. |
| 77.
Clarridge J.E., Raich T.J., Pirwani D., Simon B., Tsai L.,
Rodriguez-Barradas M.C., Regnery R.L., Zollo A., Jones D.C.,
Rambo C.: „Strategy to detect and identify Bartonella
species in routine clinical laboratory yields Bartonella
henselae from human immunodeficiency virus-positive patient
and a unique Bartonella strain from his cat.“ J. Clin.
Microbiol. 33 (1995) 2107-2113. |
| 78.
Kordick D.L., Hilyard E.J., Hadfield T.L., Wilson K.H.,
Steigerwald A.G., Brenner D.J., Breitschwerdt E.B.: „Bartonella
clarridgeiae, a newly recognized zoonotic pathogen causing
inoculation papules, fever, and lymphadenopathy (cat scratch
disease).“ J. Clin. Microbiol. 35 (1997) 1813-1818. |
| 79.
Margileth A.M., Baehren D.F.: „Chest-wall abscess
due to cat-scratch disease (CSD) in an adult with antibodies
to Bartonella clarridgeiae: case report and review of the
thoracopulmonary manifestations of CSD.“ Clin. Infect.
Dis. 27 (1998) 353-357. |
| 80.
Noguchi H., Battistini T.: „Etiology of Oroya fever.
I. Cultivation of Bartonella bacilliformis.“ J. Exp.
Med. 43 (1926) 851-864. |
| 81.
Cáceres-Ríos H., Rodríguez-Tafur J.,
Bravo-Puccio F., Mauina-Vargas C., Sanguineti Díaz
C., Ramos D.C., Patarca R.: „Verruga Peruana: An infectious
endemic angiomatosis.“ Critical. Rev. Oncogenesis
6 (1995) 47-56. |
| 82.
Ihler G.M.: „Bartonella bacilliformis: Dangerous pathogen
slowly emerging from a deep background.“ FEMS Microbiol.
Lett. 144 (1996) 1-11. |
| 83.
Chamberlin J., Gordon S., Laughlin L., Regnery R., Olson
J., Romero S., Gonzalo A.: „Diagnosis of human bartonellosis
by indirect fluorescence antibody test. 1st International
Conference on Bartonella as Emerging Pathogens.“ Abstract
no. 7, March 5-7, Tübingen, Germany, 1999. |
| 84.
Laughlin L., Chamberlin J., Ponce C., Gonzales H., Romero
S., Gonzalo A., Watts D., Carillo C.: „Epidemiology
of bartonellosis in Peru: prospective population-based study.
1st International Conference on Bartonella as Emerging Pathogens.“
Abstract no. 2, March 5-7, Tübingen, Germany, 1999. |
| 85.
Herrer A.: „Epidemiologia de la verruga peruana.“
Lima, Pribaceb (1990). |
| 86.
Ricketts W.E.: „Clinical manifestations of Carrión’s
disease.“ Arch. Intern. Med. 84 (1949) 751-781. |
| 87.
Garcia F.U., Wojta J., Broadley K.N., Davidson J.M., Hoover
R.L.: „Bartonella bacilliformis stimulates endothelial
cells in vitro and is angiogenic in vivo.“ Am. J.
Pathol. 136 (1990) 1125-1135. |
| 88.
Garcia F.U., Wojta J., Hoover R.L.: „Interaction between
live Bartonella bacilliformis and endothelial cells.“
J. Infect. Dis. 165 (1992) 1138-1141. |
| 89.
Knobloch J., Solano L., Alvarez O., Delgado E.: „Antibodies
to Bartonella bacilliformis as detected by fluorescence
antibody test, indirect haemagglutination and ELISA.“
Trop. Med. Parasitol. 16 (1985) 183-185. |
| 90.
Maas M., Schreiber M., Knobloch J.: „Detection of
Bartonella bacilliformis in cultures, blood and formulin-preserved
skin biopsies by use of polymerase chain reaction.“
Trop. Med. Parasitol. 43 (1992) 191-194. |
| 91.
Irrivaren J., Carcelen A., Gotuzzo E.: „Toxoplasmosis
en Bartonellosis.“ XIV Congreso: de TBC y Torax. Arequipa.
Peru. (1981) 189. |
| 92.
Pinkerton H., Weinman D.: „Toxoplasma infection in
man.“ Arch. Pathol. 30 (1940) 374-392. |
| 93.
Weiss P.: „Hacia una concepción de la verruga
peruana.“ Annals of the Faculty of Medicine of Lima
9 (1926) 279-300. |
| 94.
Mosing H.: „Une nouvelle infection à Rickettsia
weigli (nov. spec.).“ Arch. Inst. Pasteur Tunis 25
(1936) 373-387. |
| 95.
Jungmann P., Kuczynski M.D.: DMW. 12 (1917) 358-62. |
| 96.
Weigl R.: „Further studies on Rickettsia rocha-limae
(nov. spec.).“ J. Trop. Med. Hyg. 27 (1924) 14-15. |
| 97.
Töpfer H.: „Zur Ursache und Übertragung
des Wolhynischen Fiebers.“ Münch. Med. Wochenschrift
63 (1916) 1495-1496. |
| 98.
Vinson J.W., Fuller H.S.: „Studies on trench fever.
1. Propagation of Rickettsia-like organisms form a patients
blood.“ Pathol. Microbiol. 24 (1961) 152-166. |
| 99.
Vinson J.W., Varela G., Molina-Pasquel C.: „Trench
fever. 3. Introduction of clinical disease in volunteers
inoculated with Rickettsia quintana propagated on blood
agar.“ Am. J. Trop. Med. Hyg. 18 (1969) 713-722. |
| 100.
Koehler J.E., Quinn F.D., Berger T.G., LeBoit P.E., Tappero
J.W.: „Isolation of Rochalimaea species from cutaneous
and osseous lesions of bacillary angiomatosis.“ N.
Engl. J. Med. 327 (1992) 1625-1631. |
| 101.
Rocha Lima H.: „Untersuchungen über Fleckfieber.“
Münch. Med. Wochenschrift 63 (1916) 1381-1384. |
| 102.
Jackson L.A., Spach D.H.: „Emergence of Bartonella
quintana infection among homeless persons.“ Emerg.
Infect. Dis. 2 (1996) 141-142. |
| 103.
Spach D.H., Kanter A.S., Dougherty M.J., Larson A.M., Coyle
M.B., Brenner D.J., Swaminathan B., Matar G.M., Welch D.F.,
Root R.K., Stamm W.E.: „Bartonella (Rochalimaea) quintana
bacteremia in inner-city patients with chronic alcoholism.“
N. Engl. J. Med. 332 (1995) 424-428. |
| 104.
Relman D.A.: „Has trench fever returned?“ N.
Engl. J. Med. 332 (1995) 463-464. |
| 105.
Stein A., Raoult D.: „Return of trench fever.“
Lancet 345 (1995) 450-451. |
| 106.
Rydkina E.B., Roux V., Gagua E.M., Predtechenski A.B., Rarasevich
I.V., Raoult D.: „Bartonella quintana in body lice
collected from homeless persons in Russia.“ Emerg.
Infect. Dis. 5 (1999) 176-178. |
| 107.
Relman D.A., Loutit J.S., Schmidt T.M., Falkow S., Tompkins
L.S.: „The agent of bacillary angiomatosis. An approach
to the identification of uncultured pathogens.“ N.
Engl. J. Med. 323 (1990) 1573-1580. |
| 108.
Slater L.N., Welch D.F., Hensel D., Coody D.W.: „A
newly recognized fastidious gramnegative pathogen as a cause
of fever and bacteremia.“ N. Engl. J. Med. 323 (1990)
1587-1593. |
| 109.
Debré R., Lamy M., Jammet M.L., Costil L., Mozziconacci
P.: „La maladie des griffes de chat.“ Bull.
Mem. Soc. Med. Hop. Paris. 66 (1950) 76-79. |
| 110.
Greer W.E.R., Keefer C.S.: „Cat scratch disease: a
disease entity.“ N. Engl. J. Med. 244 (1951) 545-458. |
| 111.
Daniels W.B., MacMurray F.G.: „Cat scratch disease:
report of one hundred and sixty cases.“ JAMA 154 (1954)
1247-1251. |
| 112.
Margileth A.M.: „Cat scratch disease.“ Adv.
Pediatr. Infect. Dis. 8 (1991) 1-21. |
| 113.
Jackson L.A., Perkins B.A., Wenger J.D.: „Cat scratch
disease in the United States: An analysis of three national
databases.“ Am. J. Public. Health. 83 (1993) 1707-1711. |
| 114.
Carither H.A., Carithers C.M., Edwards R.O.: „Cat-scratch
disease, its natural history.“ JAMA 207 (1969) 312-316. |
| 115.
Carither H.A.: „Cat scratch disease: an overview based
on a study of 1200 patients.“ Am. J. Dis. Child. 139
(1985) 1124-1133 |
| 116.
Dolan M.J., Wong M.T., Regnery R.L., Jorgensen J.H., Garcia
M., Peters J., Drehner D.: „Syndrome of Rochalimaea
henselae adenitis suggesting cat scratch disease.“
Ann. Intern. Med. 118 (1993) 331-336. |
| 117.
Sander A., Ridder G.J.: „Cat-Scratch Disease –
not only a children’s Disease. 1st International Conference
on Bartonella as Emerging Pathogens.“ Tübingen,
Germany. March 5-7, 1999. J. Microbiol. Methods (1999) 268-269. |
| 118.
Zangwill K.M., Hamilton D.H., Perkins B.A., Regnery R.L.,
Plikaytis B.D., Hadler J.L., Cartter M.L., Wenger J.D.:
„Cat scratch disease in Connecticut.“ New. Engl.
J. Med. 329 (1993) 8-13. |
| 119.
Ridder G.J., Richter B., Laszig R., Sander A.: „A
farmer with a lump in his throat.“ The Lancet 351
(1998) 954. |
| 120.
Ridder G.J., Boedeker C.C., Technau-Ihling K., Grunow R.,
Sander A.: „The role of Cat-scratch Disease in Lymphadenopathy
of the Head and Neck.“ Clin. Infect. Dis. 35 (2002)
643-649. |
| 121.
Hamilton D.H, Zangwill K.M., Hadler H.L., Cartter M.L.:
„Cat-scratch disease – Connecticut, 1992-1993.“
J. Infect. Dis. 172 (1995) 570-573. |
| 122.
Anderson B.E., Neuman M.A.: „Bartonella spp. as emerging
human pathogens.“ Clin. Microbiol. Rev. 10 (1997)
203-219. |
| 123.
Bass J.W., Vincent J.M., Person D.A.: „The expanding
spectrum of Bartonella infections: II Cat-scratch disease.“
Pediatr. Infect. Dis. J. 16 (1997) 163-179. |
| 124.
Sander A.: „Katzenkratzkrankheit IV-1.19.“ In:
Hofmann (Hrsg.) Infektiologie. Ecomed Verlag, 24. Erg. Lfg.
2/1998. |
| 125.
Sander A., Kaliebe T., Bredt W.: „Bartonella (Rochalimaea)-Infektionen:
Katzenkratzkrankheit und bazilläre Angiomatose.“
Dtsch. Med. Wschr. 121 (1996) 65-69. |
| 126.
Schwartzman W.A.: „Infections due to Rochalimaea:
the expanding clinical spectrum.“ Clin. Infect. Dis.
15 (1992) 893-902. |
| 127.
Dalton M.J., Robinson L.E., Cooper J., Regnery R.L., Olson
J.G., Childs J.E.: „Use of Bartonella antigens for
serologic diagnosis of cat-scratch disease at a national
referral center.“ Arch. Intern. Med. 155 (1995) 1670-1676. |
| 128.
Sander A., Ruess M., Deichmann K., Böhm N., Bredt W.:
„Two different genotypes of Bartonella henselae in
children with cat-scratch disease and their pet cats.“
Scand. J. Infect. Dis. 30 (1998) 387-391. |
| 129.
Margileth A.M.: „Cat-scratch disease: Etiology, diagnosis,
and therapy.“ Infect. Med. 10 (1993) 38-43. |
| 130.
Margileth A.M.: „Antibiotic therapy for cat-scratch
disease: clinical study of therapeutic outcome in 268 patients
and review of the literature.“ Pediatr. Infect. Dis.
J. 11 (1992) 474-478. |
| 131.
Carithers H.A., Margileth A.M.: „Cat-scratch disease:
acute encephalopathy and other neurological manifestations.“
Am. J. Dis. Child. 145 (1991) 98-101. |
| 132.
Marra C.M.: „Neurologic complications of Bartonella
henselae infection.“ Current Opinion in Neurology.
8 (1995) 164-169. |
| 133.
Waldvogel K., Regnery R.L., Anderson B.E., Caduff R., Caduff
J., Nadal D.: „Disseminated cat-scratch disease: detection
of Rochalimaea henselae in affected tissue.“ Eur.
J. Pediatr. 153 (1994) 23-27. |
| 134.
Sander A., Frank B.: „Paronychia caused by Bartonella
henselae.“ The Lancet 350 (1997) 1078. |
| 135.
Dangman B.C., Albanese B.A., Kacica M.A., Wallach M.T.:
„Cat scratch disease in two children presenting with
fever of unknown origin: imaging features and association
with the new causative agent, Rochalimaea henselae.“
Pediatrics 95 (1995) 767-770. |
| 136.
Ruess M., Sander A., Brandis M., Berner R.: „Portal
vein and bone involvement in disseminated cat-scratch disease:
Report of two cases.“ Clin. Infect. Dis. 31 (2000)
818-821. |
| 137.
Drancourt M., Mainardi J., Brouqui P., Vandenesch F., Carta
A., Lehnert F., Etienne J., Goldstein F., Acar J., Raoult
D.: „Bartonella (Rochalimaea) quintana endocarditis
in three homeless men.“ N. Engl. J. Med. 332 (1995)
419-423. |
| 138.
Kielstein H., Kielstein P., Sander A., Rabeling B.: „Katzenkratzkrankheit:
An diese Zoonose sollte der Hausarzt öfters mal denken!“
Der Allgemeinarzt 1 (1999) 78-83. |
| 139.
Stoler M.H., Bonfiglio T.A., Steigbigel M.T., Pereira M.:
„An atypical subcutaneous infection associated with
acquired immune deficiency syndrome.“ Am. J. Clin.
Pathol. 80 (1983) 714-718. |
| 140.
Mohle-Boetani J.C., Koehler J.E., Berger T.G., LeBoit P.E.,
Kemper C.A., Reingold A.L., Plikaytis B.D., Wenger J.D.,
Tappero J.W.: „Bacillary angiomatosis and bacillary
peliosis in patients infected with human immunodeficiency
virus: Clinical characteristics in an case-control study.“
Clin. Infect. Dis. 22 (1996) 794-800. |
| 141.
Koehler J.E., Sanchez M.A., Garrido C.S., Whitfeld M.J.,
Chen F.M., Berger T.G., Rodriguez-Barradas M.C., LeBoit
P.E., Tappero J.W.: „Molecular epidemiology of Bartonella
infections in patients with bacillary angiomatosis-peliosis.“
N. Engl. J. Med. 337 (1997) 1876-83. |
| 142.
Gasquet S., Maurin M., Brouqui P., Lepidi H., Raoult D.:
„Bacillary angiomatosis in immunocompromised patients.“
AIDS 12 (1998) 1793-1803. |
| 143.
Schmidt H.U., Kaliebe T., Poppinger J., Bühler C.,
Sander A.: „Isolation of Bartonella quintana from
an HIV-positive patient with bacillary angiomatosis.“
Eur. J. Clin. Microbiol. Infect. Dis. 15 (1996) 736-741. |
| 144.
Raoult D., Fournier P.E., Drancourt M., Marie T.J., Etienne
J., Cosserat J., Cacoub P., Poinsignon Y., Leclercq P.,
Seftone A.: „Diagnosis of 22 new cases of Bartonella
endocarditis.“ Ann. Intern. Med. 125 (1996) 646-652. |
| 145.
Hadfield T.L., Warren R., Kass M., Brun E., Levy C.: „Endocarditis
caused by Rochalimaea henselae.“ Hum. Pathol. 24 (1993)
1140-1141. |
| 146.
Spach D.H., Callis K.P., Paauw D.S., Houze Y.B., Schoenknecht
F.D., Welch D.F., Rosen H., Brenner D.J.: „Endocarditis
caused by Rochalimaea quintana in a patient infected with
human immunodeficiency virus.“ J. Clin. Microbiol.
31 (1993) 692-694. |
| 147.
Warwick W.J.: „The cat scratch syndromes. Many diseases
or one disease?“ Prog. Med. Virol. 9 (1967) 256-301. |
| 148.
Bradstreet C.M.P., Warrell D.A.: „Katzenkratzkrankheit.“
In: Infektionskrankheiten, Warrell D.A. (Hrsg). Weinheim;
Basel: Ed. Medizin, VCH (1990) 792-795. |
| 149.
Wear D.J., Margileth A.M., Hadfield T.L., Fischer G.W.,
Schlagel C.J., King F.M.: „Cat scratch disease: a
bacterial infection.“ Science. 221 (1983) 1403-1405. |
| 150.
English C.J., Wear D.J., Margileth A.M., Lissner C.R., Walsh
G.P.: „Cat-scratch disease; isolation and culture
of the bacterial agent.“ JAMA 259 (1988) 1347-1352. |
| 151.
Regnery R.L., Olson J.G., Perkins B.A., Bibb W.: „Serological
response to Rochalimaea henselae antigen in suspected cat-scratch
disease.“ The Lancet 339 (1992) 1443-5. |
| 152.
Perkins B.A., Jackson L.A., Brenner D.J., Wenger J.D., Regnery
R.L.: „Case 22-1992: pathogenesis of cat scratch disease.“
N. Engl. J. Med. 227 (1992) 1599-1600. |
| 153.
Barka N.E., Hadfield T., Patnaik M., Schwarzmann W.A., Peter
J.B.: „EIA for detection of Rochalimaea henselae-reactive
IgG, IgM and IgA antibodies in patients with suspected cat-scratch
disease.“ J. Infect. Dis. 167 (1993) 1503-1504. |
| 154.
Demers D.M., Bass J.W., Vincent J.M., Person D.A., Noyes
D.K., Staege C.M., Samlaska C.P., Lockwood N.H., Regnery
R.L., Anderson B.E.: „Cat scratch disease in Hawaii:
etiology and seroepidemiology.“ J. Pediatr. 126 (1995)
23-26. |
| 155.
Raoult D., Dupont H.T., Enea-Mutillod E.: „Positiv
predictive value of Rochalimaea henselae antibodies in the
diagnosis of cat scratch disease.“ Clin. Infect. Dis.
19 (1994) 355. |
| 156.
Sander A., Posselt M., Oberle K., Bredt W.: „Seroprevalence
to Bartonella henselae in patients with CSD and in healthy
controls. Evaluation and comparison of two commercial serological
tests.“ Clin. Diagn. Lab. Immunol. 5 (1998) 486-490. |
| 157.
Szelc-Kelly C.M., Goral S., Perez-Perez G.I., Perkins B.A.,
Regnery R.L., Edwards K.M.: „Serologic responses to
Bartonella and Afipia antigens in patients with cat scratch
disease.“ Pediatrics 96 (1995) 1137-1142. |
| 158.
Bergmans A.M.C., Groothedde J.W., Schellekens J.F.P., von
Embden J.D.A., Ossewaarde J.M., Schouls L.M.: „Etiology
of cat scratch disease: Comparison of polymerase chain reaction
detection of Bartonella (formerly Rochalimaea) and Afipia
felis DNA with serology and skin test.“ J. Infect.
Dis. 171 (1995) 916-923. |
| 159.
Goldenberger D., Zbinden R., Perschil I., Altwegg M.: „Nachweis
von Bartonella (Rochalimaea) henselae / B. quintana mittels
Polymerase-Kettenreaktion (PCR).“ Schweiz. Med. Wochenschr.
126 (1996) 207-213. |
| 160.
Sander A., Posselt M., Boehm N., Ruess M., Altwegg M.: „Detection
of Bartonella henselae DNA by two different PCR assays and
determination of the genotype in histologically defined
cat scratch disease.“ J. Clin. Microbiol. 37 (1999)
993-997. |
| 161.
Nadal D., Zbinden R.: „Serology to Bartonella (Rochalimaea)
henselae may replace traditional diagnostic criteria for
cat-scratch disease.“ Eur. J. Pediatr. 154 (1995)
906-908. |
| 162.
Rath P.M., von Recklinghausen G., Ansorg R.: „Seroprevalence
of Immunoglobulin G antibodies to Bartonella henselae in
cat owners.“ Eur. J. Clin. Microbiol. Infect. Dis.
16 (1997) 326-327. |
| 163.
Sander A., Zagrosek A., Bredt W., Schiltz E., Piémont
Y., Lanz C., Dehio C.: „Characterization of Bartonella
clarridgeiae Flagellin (FlaA) and Detection of Anti-Flagellin
Antibodies in Patients with Lymphadenopathy.“ J. Clin.
Microbiol. 38 (2000) 2943-2948. |
| 164.
Brenner S.A., Rooney J.A., Manzewitsch P., Regnery R.L.:
„Isolation of Bartonella (Rochalimaea) henselae: Effects
of methods of blood collecting and handling.“ J. Clin.
Microbiol. 35 (1997) 544-547. |
| 165.
Larson A.M., Dougherty M.J., Nowowiejski D.J., Welch D.F.,
Matar G.M., Swaminathan B., Coyle M.B.: „Detection
of Bartonella (Rochalimaea) quintana by routine acridine
orange staining of broth blood cultures.“ J. Clin.
Microbiol. 32 (1994) 1492-1496. |
| 166.
Anderson B., Sims K., Regnery R., Robinson L., Schmidt M.J.,
Goral S., Hager C., Edwards K.: „Detection of Rochalimaea
henselae DNA in specimens from cat scratch disease patients
by PCR.“ J. Clin. Microbiol. 32 (1994) 942-948. |
| 167.
Goldenberger D., Schmidheini T., Altwegg M.: „Detection
of Bartonella henselae and Bartonella quintana by a simple
and rapid procedure using broad-range PCR amplification
and direct single-strand sequencing of part of the 16S rRNA
gene.“ Clin. Microbiol. Infect. 3 (1997) 240-245. |
| 168.
Mouritsen C.L., Litwin C.M., Maiese R.L., Segal S.M., Segal
G.H.: „Rapid polymerase chain reaction-based detection
of the causative agent of cat scratch disease (Bartonella
henselae) in formalin-fixed, paraffin-embedded samples.“
Hum. Pathol. 28 (1997) 820-826. |
| 169.
Sander A., Penno S.: „Semiquantitative Species-Specific
Detection of Bartonella henselae and Bartonella quintana
by PCR-Enzyme Immunoassay.“ J. Clin. Microbiol. 37
(1999) 3097-3101. |
| 170.
Kaschula R.O.C.: „Infectious diseases.“ In:
Berry C. (Ed.) Paediatric Pathology. 3rd Edition, Springer
London (1996) 729-820. |
| 171.
Urteaga O., Payne E.H.: „Treatment of the acute febrile
phase of Carrion’s disease with chloramphenicol.“
Am. J. Trop. Med. 4 (1955) 507-511. |
| 172.
Bass J.W., Treitas B.C., Treitas A.D., Sisler C.L., Chan
D.S., Vincent J.M., Person D.A., Claybaugh J.R., Wittler
R.R., Weisse M.E., Regnery R.L., Slater L.N.: „Prospective
randomized double blind placebo-controlled evaluation of
azithromycin for treatment of cat-scratch disease.“
Pediatr. Infect Dis. J. 17 (1998) 447-452. |
Anschrift der Verfasserin:
PD Dr. med. Anna Sander
Inst. für Medizinische Mikrobiologie und Hygiene, Albert-Ludwigs-Universität
Freiburg
D-79104 Freiburg, Hermann-Herder-Str. 11
E-Mail:
sander@ukl.uni-freiburg.de
|
|
|