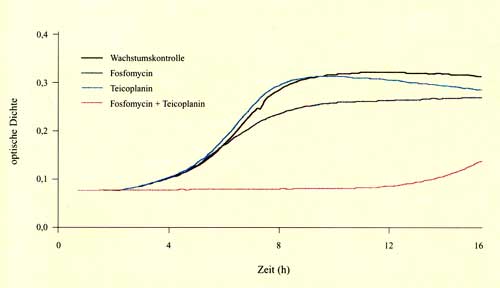
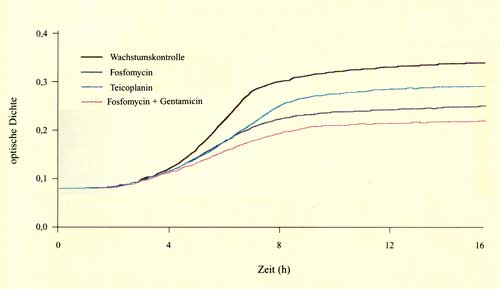
| Aktivität von Fosfomycin in Kombination mit Ampicillin, Gentamicin, Moxifloxacin, Vancomycin und Teicoplanin gegenüber Enterokokken mittels Bioscreen-C-Analyzer |
| A. Georgopoulos 1,
P. Bezecny 1, A. Buxbaum 2, W. Graninger 1 1 Universitätsklinik für Innere Medizin I, Abteilung für Infektionen und Chemotherapie, AKH Wien (Vorstand: Univ.-Prof. DDr. W. Graninger) 2 Universitätsklinik für Innere Medizin IV, Abteilung für Pulmologie, AKH Wien (Vorstand: Univ.-Prof. Dr. L.H. Block) |
| Schlüsselwörter:
Fosfomycin, Kombination, Spektrophotometrie |
Zusammenfassung Fünfzig Vancomycin-empfindliche und sechs Vancomycin-resistente klinische Enterokokken-Isolate wurden mittels Bouillon-Mikrodilutionsmethode auf ihre Empfindlichkeit gegenüber Fosfomycin, Ampicillin, Piperacillin-Tazobactam, Ceftazidim, Cefpirom, Cefepime, Ceftriaxon, Imipenem, Meropenem, Gentamicin, Vancomycin, Teicoplanin und Moxifloxacin ausgetestet. Fosfomycin MHKs bewegten sich zwischen 16 und 128 µg/ml und zeigten keine Abhängigkeit vom Resistenzmuster der Stämme. Um die Aktivität von Kombinationen von Fosfomycin mit Ampicillin, Gentamicin, Teicoplanin, Vancomycin und Moxifloxacin zu evaluieren, wurden spektrophotometrische Assays mittels des Bioscreen-C-Analyzers, eines automatisierten Turbidometers, durchgeführt. Alle fünf getesteten Antibiotika zeigten in Kombination mit Fosfomycin einen additiven oder synergistischen Effekt bei der Mehrzahl der Stämme. Während dieser Effekt bei Vancomycin, Gentamicin und Moxifloxacin nur schwach ausgeprägt war, zeigte sich eine deutlichere Wirkung bei der Kombination von Fosfomycin und Ampicillin oder Teicoplanin. Die effektivste Kombination war hierbei Fosfomycin und Teicoplanin, die eine synergistische Wirkung bei 44 von 50 Vancomycin-empfindlichen und bei vier von sechs Vancomycin-resistenten Enterokokken erbrachte. Um die Ergebnisse des Bioscreen-C-Analyzers mit einer konventionellen Technik zu vergleichen, wurden zusätzliche Experimente mit der Checkerboard-Technik durchgeführt. Hier zeigte sich durchwegs gute Korrelation bei den zwei Methoden. Es scheint, dass spektrophotometrische Messungen eine wertvolle Methode zur Aktivitätsbeurteilung von Antibiotikakombinationen sein können. |
Key-words: Fosfomycin, combination, spectrophotometry |
Summary Fifty vancomycin-susceptible and six vancomycin-resistant clinical strains of enterococci were tested on their susceptibility to fosfomycin, ampicillin, piperacillin-tazobactam, ceftazidime, cefpirome, cefepime, ceftriaxone, imipenem, meropenem, gentamicin, vancomycin, teicoplanin and moxifloxacin in vitro by the broth microdilution method. Fosfomycin MICs ranged from 16 to 128 µg/ml and were not significantly influenced by the antibiotic susceptibility patterns of the strains. The activity of fosfomycin, a phosphonic acid derivative with a broad spectrum of bactericidal activity against gram-positive cocci and several gram-negative bacteria, combined with vancomycin, teicoplanin, moxifloxacin, gentamicin, and ampicillin was studied in kinetic spectrophotometric assays using the automatic turbidometer Bioscreen-C-Analyzer which permits continuous monitoring of bacterial growth. All six antibiotics provided a synergistic or additive effect in combination with fosfomycin against most enterococcal strains. While a weak or moderate beneficial effect was observed with vancomycin, gentamicin and moxifloxacin, a strong effect was demonstrated if fosfomycin was combined with teicoplanin and ampicillin. Fosfomycin and teicoplanin appeared to be the most effective combination and exhibited synergistic activity against 44 of 50 vancomycin-susceptible and four of six vancomycin-resistant strains, respectively. To compare the Bioscreen results with a conventionally used technique, evaluation of antibiotic combinations was performed also by checkerboard titration. Good overall correlation between the spectrophotometric assay and the checkerboard technique could be observed. We conclude that the new approach of spectrophotometric assessment of antimicrobial combinations using the Bioscreen-Analyzer could be a valuable alternative for routine investigations. |
Einleitung Der Einsatz von Antibiotikakombinationen, um eine ausreichende in vivo-Aktivität gegenüber einzelnen Antibiotika-resistenten Keimen zu erreichen, ist Gegenstand zahlreicher Studien auf der ganzen Welt. In Zeiten ständig steigender Resistenzraten stellt hier die Behandlung von schweren nosokomialen Infektionen, und insbesondere mit grampositiven Pathogenen wie Methicillin-resistenten Staphylokokken oder multi-resistenten Enterokokken, ein besonderes klinisches Problem dar [1, 2]. Der goldene Standard bei der Therapie von Enterokokken-Infektionen bleibt die synergistisch wirkende Kombination eines Zellwand-aktiven Antibiotikums wie z.B. eines ß-Laktames oder eines Glykopeptides mit einem Aminoglykosid [3]. Unverträglichkeitsreaktionen und die zunehmende Anzahl von multi- und hochresistenten Enterokokkenstämmen unterstreichen allerdings die Wichtigkeit der Suche nach neuen Substan-zen oder Substanzkombinationen mit Anti-Enterokokken-Aktivität. In dieser Studie wurde die in vitro-Aktivität von Fosfomycin allein und in Kombination bei Vancomycin-empfindlichen und Vancomycin-resistenten klinischen Isolaten von Enterococcus faecalis und Enterococcus faecium bestimmt. Dazu wurde eine neue spektrophotometrische Methode – der Bioscreen-C-Analyzer, der kinetische Bestimmungen erlaubt – verwendet [4]. Zur Evaluierung dieser Methode wurden ebenfalls Bestimmungen mit der Standardmethode – der Checkerboard-Technik – durchgeführt. |
|
Bakterienstämme
und Medien
Antibiotika
Minimale Hemmkonzentrationen (MHK) Bestimmung
der Aktivität von antibiotischen Kombinationen
1) Checkerboard-Technik
2)
Bioscreen-C-Analyzer
AUC0, AUCA, AUCB, und AUC(A+B) stellen die AUC0-16 Werte dar, die ohne Antibiotikum (AUC0), mit Antibiotikum A (AUCA), Antibiotikum B (AUCB) oder mit den Antibiotika A und B (AUC(A+B)) erzielt wurden. |
|
MHK
Aktivität
der Antibiotika-Kombinationen
Vergleich
von Checkerboard-Technik und Bioscreen-C-Analyzer |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Die Ziele dieser Studie waren zweifach: i) die Suche nach der antibiotischen Kombination mit der größten Anti-Enterokokken-Aktivität ii) die Evaluierung des kinetischen Bioscreen-Assays als Routine-Screening-Methode. Die
Bestimmung des FIC mit der Checkerboard-Methode hat Nachteile: Es erwies sich der Bioscreen-Assay als durchaus taugliche Methode für das rasche Screening von antibiotischen Kombinationen in der Routine. Der Vergleich mit den Ergebnissen der Checkerboard-Methode zeigte eine gute Korrelation. Divergierende Ergebnisse sind auf unterschiedliche Definitionen der beiden Methoden zurückzuführen (additiv: Summe der Resultate der einzelnen Substanzen im Checkerboard vs. kombinierte Aktivität der einzelnen Substanzen im Bioscreen-Assay). Einige Autoren beschäftigten sich mit der Interaktion von Fosfomycin mit anderen Zellwand-aktiven Substanzen. Hierbei zeigte sich nur eine geringe Kreuzresistenz zwischen Fosfomycin und anderen Substanzklassen wie ß-Laktamen oder Aminoglykosiden [6, 7, 8]. Ebenso wurden synergistische Effekte von Fosfomycin und ß-Laktamen und Fosfomycin und Daptomycin gegenüber Enterokokken beobachtet. In dieser Studie lagen die MHK50 und MHK90 der getesteten Enterokokkenisolate bei 64 und 128 µg/ml; weiters zeigte sich kein Zusammenhang zwischen Resistenz gegenüber Fosfomycin und Resistenz gegenüber den anderen Substanzen [9, 10]. Als am wirksamsten erwies sich die Kombination von Fosfomycin mit Teicoplanin oder Ampicillin, unabhängig vom Resistenzmuster der einzelnen Stämme [8, 9, 11]. Diese Kombinationen scheinen den Kombinationen von Fosfomycin und Aminoglykosid oder Quinolon deutlich überlegen zu sein. Aus diesem Grunde sollte die Kombination von Fosfomycin mit Teicoplanin oder einem ß-Laktam wie Ampicillin als Therapiealternative bei der Behandlung von schweren Enterokokkeninfektionen in klinischen Prüfungen evaluiert werden. |
| Literatur:
1. Eliopoulos G.M., Moellering
Jr. R.C.: „Antimicrobial combinations.“ In Antibiotics in laboratory
medicine, 3rd edn. (Lorian, V., Ed.) The Williams & Wilkins Co.,
Baltimore, Md. (1992) 432-92. |
| Anschrift
des Verfassers: Univ.-Prof. DDr. A. Georgopoulos Univ.-Klinik für Innere Medizin I, Abt. für Infektionen und Chemotherapie A-1090 Wien, Währinger Gürtel 18-20 |