| Sepsis – Neue Erkenntnisse zur Pathogenese, Therapie und Prävention |
|
U. Kastner, S. Glasl, S. Lugauer,
J.P. Guggenbichler |
| Schlüsselwörter:
Sepsis, SIRS, Pathogenese, bakterielle Translokation, Adhärenzblockierung, saure Oligosaccharide |
|
Die Behandlung der Sepsis, die sich neben kreislauferhaltenden Maßnahmen immer noch primär auf eine kalkulierte antimikrobielle Chemotherapie stützt, wurde in den letzten Jahren um zahlreiche neue Therapieansätze erweitert. Neben der Beeinflussung des Entzündungssystems durch Hemmung spezifischer Mediatoren steht neuerdings der Einsatz von aktiviertem Protein C zur Diskussion. Ein innovativer Ansatz erfasst die Verhinderung der mikrobiellen Translokation durch Blockierung der Adhärenz pathogener und fakultativ pathogener Keime an die Darmschleimhaut. In der Blockierung dieses initialen Schritts der Pathogenese haben sich in vitro und im Tierversuch saure Oligosaccharide als wirksam erwiesen, die in Zukunft in der Prävention und Therapie der Sepsis klinisch eingesetzt werden könnten. |
Key-words: Sepsis, SIRS, pathogenesis, bacterial translocation, blocking of adherence, acidic oligosaccharides |
|
The therapy of sepsis is based on the regulation of cardio-circulatory dysfunction and on a calculated antimicrobial chemotherapy. Recently, antibodies to inflammatory agents and activated protein C have been discussed as new agents in the first line therapy of sepsis. Further efforts are focused on the prevention of bacterial translocation by blocking adherence of microbial pathogens to the intestinal mucosa. Acidic oligosaccharides have proofed to function as selective inhibitors of initial bacterial adherence and might present an innovative approach in the prevention and therapy of sepsis in the future. |
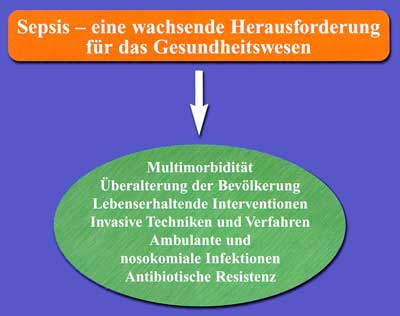
Pathogenese und Epidemiologie Sepsis und Multiorganversagen sind
weltweit die Letalitätsfaktoren Nummer eins und gehören zu den ungelösten
Problemen der Medizin. Nach vorsichtigen Schätzungen sterben derzeit
jährlich immer noch weltweit rund 500.000 Patienten an den Folgen
einer „Blutvergiftung“, das sind 1.400 pro Tag. In Österreich dürfte
die Zahl in der Größenordnung von 15.000 jährlich liegen. In Krankenhäusern
der Maximalversorgung beträgt die Inzidenz in Deutschland pro 1.000
stationären Patienten zwischen 8,1 und 15, wobei die Frequenz auf
Intensivstationen am höchsten ist und in Abhängigkeit von dem Patientengut
und den Kriterien zur Sepsis-Diagnose variiert. In den OECD-Mitgliedsstaaten
wurden 1995 1,5 Millionen Fälle an schwerer Sepsis gemeldet, in
den USA lag für den gleichen Zeitraum die Rate bei ca. 700.000 Patienten,
entsprechend einer Inzidenz von 3/1.000. Die jährliche Belastung
des Gesundheitsbudgets durch die Behandlung von Patienten mit schwerer
Sepsis wurde in den USA auf 17 Billionen Dollar geschätzt [1, 2]
(Abbildung 1).
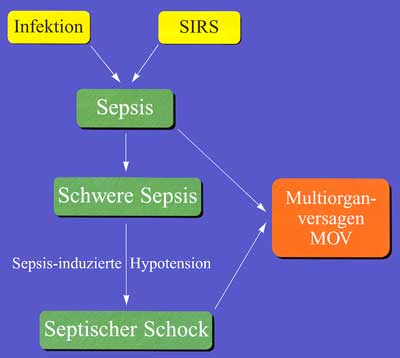
Der Begriff „Sepsis“ stammt aus dem Griechischen (= Gärung, Fäulnis) und umschreibt ursprünglich eine in der Regel letal verlaufende mikrobielle Erkrankung. In der Vergangenheit wurden die Begriffe wie Sepsis, Septikämie und Sepsis-Syndrom sehr unterschiedlich definiert, was zu unklaren epidemiologischen Daten, widersprüchlichen Ergebnissen aus klinischen Studien und folglich auch daraus resultierenden Therapie-Empfehlungen führte. R.C. Bone, der bereits vor ca. 10 Jahren die unterschiedliche Nomenklatur kritisierte, startete 1991 den Versuch, eine einheitliche Definition des Krankheitsbildes zu schaffen, mit dem Ziel, Patienten frühzeitig als septisch zu erkennen und Risikofaktoren für die Entwicklung eines septischen Ereignisses bereits bei der Aufnahme des Patienten zu evaluieren [3]. Dieser Denkansatz wurde von den Gesellschaften des „American College of Chest Physicians“ und der „Society of Critical Care Medicine“ aufgegriffen, die sich noch im selben Jahr zu einer Consensus Conference zusammenfanden, um die Definition von Sepsis und deren Folgen (wie z.B. das klinische Bild des septischen Schocks) sowohl allgemein verbindlich zu definieren als auch klinische Richtlinien zu geben, mit deren Hilfe Patienten als „septisch“ erkannt werden können. Der früher gebräuchliche Ausdruck der „Septikämie“ sollte demnach weder im klinischen Alltag noch bei der Konzeption von klinischen Studien herangezogen werden. Heute versteht man unter Sepsis die Summe lebensbedrohlicher Krankheitssymptome und pathophysiologischer Veränderungen, verursacht durch pathogene Keime und ihre Produkte, die aus einem Infektionsherd in die Blutstrombahn eindringen, durch die Bildung von endogenen Mediatoren (Zytokinen) die Entzündungskaskade aktivieren und zu einer nicht mehr kontrolliert ablaufenden systemischen Entzündungsreaktion führen. Der mit dieser Entzündungsreaktion einhergehende klinische Symptomkomplex wird als Systemic Inflammatory Response Syndrome (SIRS) bezeichnet. SIRS kann jedoch auch primär als
Folge nicht infektiöser Ursachen ausgelöst werden, dazu zählen Pankreatitis,
große operative Eingriffe, Operationen mit extrakorporaler Zirkulation,
Ischämie, Polytrauma, ausgedehnte Gewebsnekrosen, z.B. bei Verbrennungen,
hämorrhagischer Schock oder immunvermittelte Organschäden. SIRS
ist demgemäß ein Symptomkomplex, der durch ein schweres Ereignis
hervorgerufen wird; ist dafür eine mikrobielle Infektion verantwortlich,
spricht man von einer Sepsis. Die physiologischen Parameter, die
definitionsgemäß bei der Diagnose einer Sepsis erfüllt werden müssen,
sind in Tabelle 1 bzw. Abbildung 2 zusammengefasst. Dabei ist festzuhalten,
dass SIRS (d.h. keine nachgewiesene Infektion) und Sepsis (d.h.
nachgewiesene Infektion) offenbar ein identisches Erscheinungsbild
bieten können.
Die Befunde und Symptome einer Sepsis sind sehr variabel und einzeln betrachtet weder spezifisch noch beweisend. Primäre Symptome können Hyper- oder Hypothermie, Schüttelfrost, Tachykardie, Tachypnoe und/ oder Hautveränderungen (Petechien, Erythem, Ecthyma gangraenosum) sein. Eine Aggravierung dieser Symptome wurde durch die Consensus Conference unter dem Begriff „schwere Sepsis“ subsumiert. Bei dieser schweren Art der Sepsis zeigen die Patienten zusätzlich Anzeichen der Organminderperfusion, weitere geforderte Kriterien sind eine Laktatazidose und eine Oligurie. Zusätzliche Anzeichen für eine Verschlechterung sind Veränderungen des mentalen Zustandes, welche allerdings beim intubierten und beatmeten Patienten kaum verifiziert werden können. Der Begriff „septischer Schock“ impliziert das Vorliegen des Symptomkomplexes „Sepsis“ plus einer relevanten anhaltenden Hypotension (RR systolisch < 90/min) trotz ausreichender Flüssigkeitszufuhr. Um ein infektiöses Geschehen nachzuweisen, muss mehrfach Blut für mikrobiologische Untersuchungen abgenommen werden. Ein positiver Erregernachweis beweist eine bakterielle oder Pilz-assoziierte Sepsis. Die Wahrscheinlichkeit, einen Erregernachweis bei einer „Septikämie“ zu führen, liegt zwischen 30 und 50%, die Trefferquote steigt mit der Anzahl der Blutkulturen und fällt mit dem Abstand zur ersten Fieberzacke. Mit zwei bis drei Blutkulturen innerhalb von 24 Stunden wird bereits eine Sensitivität von 99% erreicht. Allerdings finden sich in der Literatur Angaben über durchschnittlich 60% positive Blutkulturen bei Patienten mit suspizierter Sepsis, die restlichen 40% werden einem SIRS mitschwerwiegender Gewebeschädigung als kausaler Ursache zugeschrieben [6, 7]. Auslöser einer Sepsis oder eines septischen Schocks können Bakterien, Viren, Pilze oder Parasiten sein. Durch Freisetzung von mikrobiellen Strukturen (z.B. Endotoxine, Exotoxine, Superantigene) wird die Ausschüttung von endogenen Mediatoren, wie Interleukinen, Tumornekrosefaktoren, Histamin, Serotonin, Sauerstoffradikalen und Proteasen, stimuliert. Diese führen durch Aktivierung von Leukozyten und humoralen Abwehrsystemen zu den für den septischen Schock typischen Veränderungen, die charakterisiert sind durch
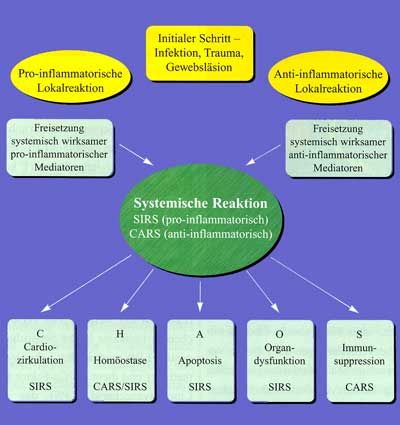
Durch diese Veränderung kommt es zu einem Perfusionsdefizit in verschiedenen Organen, das bei Fortbestehen über mehrere Tage zur Entstehung eines SIRS mit lokalen Ödemen und Zellschädigungen führt. Diese Phase wird bei Beteiligung von mehr als 2 Organen als Multi-Organ-Dysfunktions-Syndrom (MODS) bezeichnet. Hält das Perfusionsdefizit an, entsteht eine Stase im Splanchnikusgebiet, wodurch es zu einer Schädigung der gastrointestinalen Barriere mit konsekutiver Translokation von Bakterien und Endotoxinen kommt. Das führt kaskadenartig zu einer Potenzierung der klinischen Symptomatik und zum Vollbild der Sepsis. Aus der Organdysfunktion wird ein Multiorganversagen (MOV) als Resultat einer inadäquaten Antwort körpereigener Mediator- und Zellsysteme auf einen infektiologischen Reiz oder eine exzessive Gewebeschädigung. Frühe klinische Zeichen einer Sepsis sind die sepsisbedingte Hypotension, die warme Rötung der Haut – zunächst bis in die Akren – und die psychomotorische Unruhe des Patienten. Typische Symptome für eine Generalisierung der Infektion im Sinne einer Sepsis wie Fieber, Tachypnoe, Hypo- und Hyperthermie, Schüttelfrost, Hyperventilation, Vigilanzstörung, Leukozytose, Leukopenie oder Hautveränderungen können jedoch auch bei systemischen, nicht infektiösen Entzündungsreaktionen auftreten. Die sehr eng gefassten Kriterien der „Consensus Conference“ finden nicht immer und allerorts Zuspruch und Beachtung. Besonders in der angloamerikanischen Literatur werden Forderungen nach Weiterentwicklung der Definitionen in Anlehnung an die zunehmend neuen Erkenntnisse über die Pathogenese und Pathophysiologie postuliert. Das MOV wird heute als Folge einer komplexen und generalisierten Entzündungsreaktion interpretiert, die durch die Freisetzung von Zytokinen induziert und in Gang gehalten wird. Bislang ist es nicht gelungen, ein spezifisches Zytokin für den Beginn der Kaskade und somit die Ursache von SIRS auf der Ebene der inflammatorischen Zytokine zu definieren, nicht zuletzt auch deshalb, weil die Zytokinausschüttung letztlich als gezielte und physiologische Antwort auf eine Gewebeschädigung oder Infektion verstanden werden muss. Bekannterweise werden Zytokine bei unterschiedlichen Krankheitsbildern freigesetzt, ohne zwingend das Bild eines SIRS zu induzieren. Diese Tatsache führte zu der Überlegung, dass die Freisetzung von Zytokinen und somit die Pathogenese der Sepsis nicht nur ein Wechselspiel pro-inflammatorischer Mediatoren darstellt, sondern auch je nach Abwehrlage ein entsprechendes anti-inflammatorisches System zum Tragen kommt. Die Summe dieser Effekte, die der Körper den akuten Entzündungsreaktionen entgegensetzt, wird als Compensatory Anti-inflammatory Reaction Syndrome (CARS) bezeichnet und bestimmt je nach Wiederherstel- lung oder Verlust der Homöostase die Schwere der Erkrankung (Abbildung 3). Nach Bone et al. wird unter CARS im engeren Sinn ein HLA-DR-Nachweis < 30% auf Monozyten mit einer verminderten Fähigkeit zur Produktion von Entzündungs-Zytokinen (TNF-a, IL-1, IL-6) definiert. Tabelle 2 zeigt die bislang in der Literatur akzeptierten Mediatoren des komplexen Wechselspiels, die immer wieder als viel versprechende Ansatzpunkte für die Entwicklung neuer Therapien postuliert wurden. Mittlerweile muss allerdings festgestellt werden, dass der Schlüssel zur Behandlung der Sepsis nicht in der Hemmung einzelner Zielmediatoren liegt. Die Antagonisierung eines oder mehrerer Faktoren der pro-inflammatorischen Entzündungskaskade hat sich zwar in vitro und im Tiermodell teilweise als erfolgreich erwiesen, die Umsetzung auf den Menschen jedoch brachte eher ernüchternde Ergebnisse, die erneut die Komplexität und die großen interindividuellen Unterschiede im Ablauf der systemischen Entzündungsreaktion widerspiegeln [8].
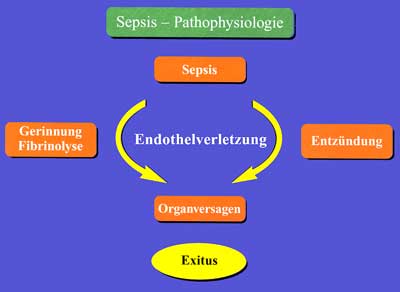
Hinzu kommt, dass im Rahmen einer Sepsis auch das Gerinnungssystem erheblich gestört ist. Durch die Interaktion von Granulozyten und Gefäßendothel werden Faktoren der Gerinnungskaskade und der Fibrinolyse freigesetzt, die im Falle einer Imbalance zu einer Verbrauchskoagulopathie, einer disseminierten intravasalen Gerinnung (DIC) mit mikrovaskulären Thrombosen und letztlich zum Organversagen führen. Neben den frühen Zeichen der Koagulopathie (Anstieg der D-Dimere und des Thrombin-Antithrombin-Komplexes) werden zunehmend auch weitere antifibrinolytische und fibrinolytische Faktoren als diagnostische und prädiktive Zeichen herangezogen. Dabei nehmen die aktivierten Faktoren XII und VIII, das Protein-C-System, Antithrombin III und das Endothelzell-protein tissue factor pathway inhibitor (TFPI) eine zentrale Rolle im Wechselspiel zwischen Endothelzellschädigung und Regulation von Entzündungs- und Gerinnungsfaktoren ein, wobei vor allem dem aktivierten Protein C neben dem antithrombotischen Effekt auch eine direkte anti-inflammatorische Wirkung (Hemmung der Zytokinproduktion und Anlagerung von Leukozyten an das Endothel) zugesprochen wird. Ein Abfall von Protein C und Fibrinogen in Kombination mit dem Anstieg der D-Dimere und einer Verlängerung der aPTT sind mit dem klinischen Bild einer schweren Sepsis vereinbar (Abbildung 4). Endogene Homöostasemodulatoren wie Protein C und AT-III werden verbraucht, die Aktivierung von Protein C durch endotheliale Oberflächenproteine wie z.B. Thrombomodulin oder dem endothelialen Protein-C-Rezeptor (EPCR) ist durch die generelle Endothelschädigung vermindert. Die Folge ist eine unkontrollierte Kettenreaktion aus Entzündung, Gerinnung und Fibrinolyse, die zu einer Progredienz der systemischen Erkrankung führt und in einer ausgedehnten Ischämie, Hypoxie, Organdysfunktion und letztlich bei vielen Patienten mit dem Tod endet.
Die Diagnose einer Sepsis muss primär nach klinischen Kriterien in Anlehnung an die Empfehlungen der „Consensus Conference“ gestellt werden, unterstützt durch laborchemische Veränderungen als Zeichen der systemischen Entzündungsreaktion (e.g. Leukozytose mit Linksverschiebung oder Leukopenie, evtl. auch Thrombopenie, Gerinnungsstörung, CRP-Anstieg). Ein Anstieg des Procalcitonin (PCT) auf über 2 ng/ml wird als Hinweis auf eine Infektion gewertet. Werte über 3 ng/ml sichern die Diagnose einer Sepsis mit einer Sensitivität von 82% und einer Spezifität von 48%. Serum-Laktat-Werte korrelieren bei Patienten mit Sepsis signifikant, bei Werten von 5 mmol/l liegt die Mortalität bei über 80%. In letzter Zeit wurden weitere biochemische Parameter auf den prädiktiven Charakter für die Entwicklung eines MOV untersucht. Die Aktivierung polymorphkerniger Leukozyten (PMN) und die Höhe des IL-6-Spiegels nach großen chirurgischen Eingriffen korreliert mit dem Auftreten septischer Komplikationen. IL-6 ist also ein relativ guter Sepsis-Marker [9]. In Kombination mit den Plasmaspiegeln von sE-Selektin kann der Schweregrad der Sepsis zusätzlich abgeschätzt werden; sE-Selektin ist ein spezifischer Marker für Endothelschädigungen und damit auch für die Schwere einer Sepsis. Auch ein anhaltender Abfall des Plasma-AT-III-Spiegels und des aktivierten Protein C korreliert mit dem Beginn des MOV. D-Dimere im Plasma weisen auf die Aktivierung des Gerinnungssystems hin, Plasminogen-Aktivator Inhibitor-1 ist ein Marker für Verletzungen von Endothel [10, 11]. Lipopolysaccharid-bindendes Protein (LBP) ist ein weiterer viel versprechender Indikator in der Sepsisdiagnostik. LBP wird in der Leber synthetisiert und dient als Co-Faktor für Lipopolysaccharid (LPS), das als LBP/LPS-Komplex gebunden dem CD14-Rezeptor auf immunkompetenten Zellen präsentiert wird und zu einer Freisetzung von LPS-abbauenden Mediatoren führt. Im Gegensatz zu den meisten Proteinen der Akutphase (TNF-a, IL-1b, IL-6, IL-8) sind messbare Konzentrationen des LBP auch bei gesunden Probanden zu finden (Normwerte Männer 2,5-11,2 µg/ml, Frauen 2,0-12,2 µg/ml), eine bakterielle Infektion bei Intensivpatienten wird durch konstant hohe LBP-Spiegel angezeigt [12]. Ein erfolgreiches Routine-Monitoring zur rechtzeitigen Diagnose von septischen Komplikationen kann durch die stufenweise Bestimmung von IL-6 und LBP erfolgen. Bei IL-6-Werten > 30-60 pg/ml wird die Bestimmung von LBP empfohlen, wobei erhöhte Werte für LBP auf eine bakterielle Infektion hinweisen. Liegen die IL-6-Werte > 100 pg/ml bis mehrere 1.000 pg/ml bei gleichzeitig hohen LBP-Spiegeln, gilt eine bakterielle Sepsis laborchemisch als bewiesen. Um die Entstehung einer Sepsis und ein Multiorganversagen frühzeitig erkennen zu können, wurden zahlreiche Scores entwickelt, in klinischer Verwendung befinden sich u.a. der Sepsis-Score (SS) von Elebute und Stoner [13], der Septic Severity Score (SSS) nach Stevens [14] sowie der Multi Organ Dysfunction (MOD) Score nach Marshall [15]. Zur Verlaufsbeurteilung ist es jedoch eher ratsam, möglichst täglich Scores zur Bewertung des Allgemeinzustandes und der aktuellen physiologischen Konstellation in Abhängigkeit von Alter, Geschlecht und Grunderkrankung, wie den APACHE II/III oder SAPS II (Simplified Acute Physiology Score), zu erheben [16, 17]. Die klinische Relevanz der genannten Scoring Systems wird kontroversiell diskutiert, sie sind für die Einschätzung des aktuellen Zustandes des individuellen Patienten und seiner Risikofaktoren möglicherweise weniger geeignet als für die indirekte Risikoabschätzung einer Patientengruppe bzw. für die Auswertung von klinischen Studien zur Beurteilung neuer therapeutischer Konzepte in der Behandlung von Hochrisikopatienten. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Neue
Therapieansätze bei Sepsis
Die konventionelle Therapie der Sepsis beruht auf den folgenden vier Grundsäulen:
Bei begründetem Verdacht auf Vorliegen eines septischen Geschehens ist die frühzeitige antibiotische, antimykotische, antivirale und/oder antiparasitäre Chemotherapie entscheidend. Die Auswahl eines Antibiotikums für die Initialtherapie richtet sich dabei nach dem zu erwartenden Erregerspektrum, welches durch Alter, Anamnese, Grundkrankheit, Immunstatus und vom Fokus der Infektion diktiert wird. Außerdem spielen lokale Gegebenheiten hinsichtlich des Erregerspektrums und der Resistenzlage eine wesentliche Rolle [18-20]. Hierzu wurden von der Paul-Ehrlich-Gesellschaft für Chemotherapie e.V. in den vergangenen Jahren zwei große Studien zur Epidemiologie von Sepsis-Erregern durchgeführt, die als Grundlage der Therapieempfehlungen herangezogen wurden [21, 22]. Pulmonale Infektionen werden bei 47% als primärer Fokus angegeben, gefolgt von Infektionen des Gastrointestinaltraktes (15%) und des Urogenitaltraktes (10%). Bei nahezu 30% der Patienten bleibt die Suche nach dem Primärherd frustran. In einer repräsentativen Multicenter-Studie wurde beobachtet, dass die Hälfte der Fälle von Sepsis und septischem Schock nosokomial akquiriert wurden, 25% davon nachweislich auf Intensivstationen. Als Risikofaktoren für nosokomiale Infektionen gelten die erhöhte Disposition intensivgepflegter Patienten aufgrund von Grunderkrankung, infektionsbegünstigender invasiver diagnostischer und therapeutischer Maßnahmen. Ein wesentlicher Faktor ist der hohe Pflegeaufwand und damit der enge Kontakt zwischen Patient und Personal, der durch das insgesamt häufigere Auftreten von multiresistenten Erregern zu einer ungleich höheren Exposition führt als in anderen Krankenhausbereichen [19]. Werden notwendige Hygienemaßnahmen unterlassen (Händedesinfektion, Kohorten-Isolierung etc.), ist eine klonale Ausbreitung nahezu unaufhaltsam. Zusätzlich entstehen weitere Probleme durch horizontalen Transfer genetischer Informationen durch Plasmide von hochresistenten Klonen zu noch empfindlichen Bakterienstämmen, die eine suffiziente Behandlung septischer Patienten zunehmend unmöglich macht. Die empirische Therapie bei bekanntem Infektionsherd richtet sich nach der Empfindlichkeit der zu erwartenden Erreger. Sofern der Sepsisherd einer chirurgischen Intervention zugänglich ist, muss zusätzlich eine chirurgische Sanierung angestrebt werden. Bei zunächst unbekanntem Erreger sollte die initiale „kalkulierte“ Antibiotika-Therapie so breit als notwendig und so schmal als möglich gewählt werden, wobei das gramnegative und grampositive Spektrum einschließlich der anaeroben Erreger, atypischer und möglicherweise seltener Pathogene berücksichtigt werden sollte. Bei Patienten mit schwerer Neutropenie, einer bekannten pulmonalen oder urologischen Problematik sowie unter Langzeitbeatmung muss die antibiotische Therapie den individuellen Surveillance-Kulturen entsprechend dem endogenen Keimspektrum angepasst werden. Prinzipiell kann nahezu jeder Erreger bei entsprechender Abwehrlage des Patienten zu einer Sepsis führen. In den letzten Jahren haben grampositive Erreger gegenüber gramnegativen Bakterien zunehmend an Bedeutung gewonnen, insbesondere durch zusätzliche Risikofaktoren wie zentralvenöse Katheter, langfristige Sondenernährung und Langzeitbeatmung. Besonders im intensivmedizinischen Bereich sind resistente Staphylokokken (v.a. MRSA und MRSE) und Enterokokken eine zunehmende Herausforderung ebenso wie multiresistente Enterobacteriaceae und Pseudomonaden, die meist endogenen Ursprungs sind und entweder per continuitatem zu Infektionen der Atemwege führen oder durch bakterielle Translokation vom Darmlumen in die Blutbahn des Patienten gelangen [20]. Nach den Empfehlungen der Paul-Ehrlich-Gesellschaft für Chemotherapie e.V. (siehe Tabelle 3, [23]) kommen zur initialen Therapie bei Erwachsenen Cephalosporine der Gruppe 3, Piperacillin/Tazobactam, Carbapenem oder ein hoch dosiertes Fluorochinolon der Gruppe 2 in Betracht.
Ob initial eine Kombination mit einem Aminoglykosid indiziert ist, wird derzeit kontroversiell diskutiert. Bei klinisch schwerem Verlauf wird sie in den ersten 3 Tagen bis zum Vorliegen des mikrobiologischen Befundes in Kombination mit einem b-Lactam-Antibiotikum empfohlen. Eine Kombination ist jedenfalls indiziert beim Nachweis von Pseudomonaden und Enterobacter. Bei Verdacht auf Katheter-assoziierte Infektionen sollte neben der Sanierung desselben jedenfalls ein Erregernachweis mit Antibiogramm angestrebt werden, um gezielt therapeutisch vorzugehen. Lang andauernde Immunsuppression zeigt nicht selten eine Pilz-assoziierte Infektion als Komplikation und fordert den frühzeitigen Einsatz von Amphotericin B und / oder Fluconazol. Aufgrund der zunehmenden Problematik im Bereich der Resistenzentwicklung und der beschränkten Möglichkeiten der konventionellen Behandlung septischer Patienten wurden in den letzten Jahren zahlreiche Anstrengungen unternommen, neue Therapieansätze, basierend auf einem gezielten Eingriff in Teilkomplexe der Pathogenese, zu finden und einer entsprechenden klinischen Testung zu unterziehen. Rationale therapeutische Ansätze sind der Einsatz von Anti-Endotoxinen (Endotoxin-Neutralisierung beschränkt auf gramnegative Erreger, rBPI21, Polymyxin B, E5531, rHDL, Antiendotoxin-Vakzine, Mab HA-1A, E5), Immunmodulatoren (z.B. anti-TNF-AK, löslicher TNF-Rezeptor, Antibradykinin, PAF-Acetylhydrolase, IL-10, IL-1-Rezeptorantagonist, Interferon-g, G-/GM-CSF), Prostaglandinhemmer (z.B. Ibuprofen) und der Einsatz von Gerinnungsinhibitoren (AT-III, aktiviertes Protein C, TFPI). Die meisten dieser Therapiekonzepte befinden sich noch in klinischer Prüfung (Phase-II- und Phase-III-Studien) und haben nur zum Teil den erhofften Erfolg gebracht [24]. Hingegen lässt der Einsatz von rekombinantem humanem aktiviertem Protein C erstmals Hoffnung auf eine neue wirksame Option für Patienten mit schwerer Sepsis aufkommen. Protein C ist einer der Hauptregulatoren der Gerinnung, der zusammen mit dem Kofaktor Protein S als „endogenes Antikoagulans“ die Koagulationsfaktoren Va und VIIIa inaktiviert und damit die beiden geschwindigkeitsbestimmenden Faktoren der Gerinnungskaskade. Zusätzlich entfaltet aktiviertes Protein C profibrinolytische Eigenschaften, da eine Komplexinaktivierung des Plasminogen-Aktivator-Inhibitors (PAI-1) erfolgt, der dadurch nur noch in vermindertem Maß zur Inaktivierung von Plasminogenaktivatoren zur Verfügung steht. Aktiviertes Protein C vermag somit nicht nur die Bildung intravasaler Gerinnsel zu verhindern, sondern fördert zudem die Thrombolyse durch Stimulation der reaktiven Fibrinolyse und damit die Rekanalisation eines thrombotisch verschlossenen Gefäßes. Weiterhin kann aktiviertes Protein C die Adhäsion von Leukozyten am Endothel und die Freisetzung von IL-1 und TNF-a durch Monozyten blockieren, wodurch die systemische Ausbreitung von einer primär lokalisierten Entzündung gebremst werden soll. In einer multizentrischen Placebo-kontrollierten, randomisierten Studie an fast 1.700 Patienten zeigte sich eine Verringerung der Sterblichkeit unter schwerer Sepsis von 30,8% auf 24,7%, die relative Risikoreduktion betrug 19,4% [PROWESS (Protein C Worldwide Evaluation in Severe Sepsis)-Studie, 30th SCCM, San Francisco, 2001]. Damit überlebte von fünf Erkrankten ein Patient mehr, was als außergewöhnlich gutes Ergebnis interpretiert werden muss. Eine Zulassung auf dem amerikanischen und europäischen Markt ist demnächst zu erwarten, sodass das Medikament schon sehr bald auch in Österreich zur Verfügung stehen wird. Nichtsdestotrotz wird in Zukunft vor allem die Prävention septischer Komplikationen im Vordergrund stehen müssen, nicht zuletzt auch aus gesundheitspolitischen und ökonomischen Überlegungen. Die Überalterung der Bevölkerung und zunehmende Multimorbidität in Kombination mit risikoreichen chirurgischen und therapeutischen Interventionen lässt eine Zunahme von Patienten mit einem hohen Risiko zur Entwicklung einer Sepsis erwarten. Hygienische Maßnahmen und entsprechende Schulung des Personals werden auch in Zukunft einen Eckpfeiler in der Prävention von nosokomialen Infektionen einnehmen. Eine breite „präventive“ antibiotische Abschirmung von Hochrisikopatienten mit zusätzlicher selektiver Darmdekontamination ist derzeit vielerorts verbreitet, sollte aber nicht generell erfolgen, da die Induktion von multiresistenten Keimen in der endogenen Flora des Patienten gefördert und dadurch die therapeutischen Optionen im Falle einer endogenen Sepsis deutlich reduziert werden. Eine zentrale Rolle spielt dabei die intestinale Flora, die sich nach entsprechender antibiotischer Vorbehandlung innerhalb kürzester Zeit drastisch verändert und in der Regel durch multiresistente Enterokokken, Enterobacteriaceae und Pseudomonaden dominiert wird. Dieses Reservoir an Mikroorganismen darf nicht als unbedeutender Faktor in der Pathogenese negiert werden, sondern sollte vor allem bei Konzepten in der Prävention zunehmend in Betracht gezogen werden. |
||||||||||||||||||||||||||||||||||||||||
| Bakterielle
Translokation - Bedeutung in der Pathogenese der Sepsis und Ansätze
zur Prävention
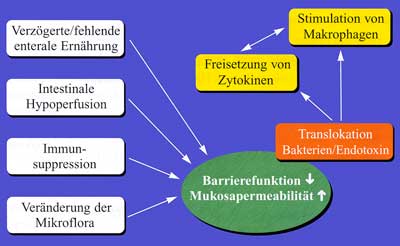
Der Begriff der „bakteriellen Translokation“
bezeichnet den Durchtritt von lebenden Bakterien und Endotoxinen
durch die Darmwand in die Pfortader sowie in die mesenterialen Lymphknoten,
was eine Bakteriämie mit möglicher Absiedelung in weitere Organe,
wie Leber und Lunge, zur Folge haben kann. Eine fehlende enterale
Substratzufuhr zusammen mit einem massiven Stressereignis (z.B.
Folge chirurgischer Eingriffe, Traumen, Immunsuppression, Verbrennungen,
hypovolämischer Schock, intestinale Hypoxie) fördert die Translokation
und Aufnahme von Bakterien und Endotoxinen in die ortsständigen
Makrophagen und die Ausschüttung von Entzündungsmediatoren, die
die Kaskade in der Pathogenese von SIRS starten und aufrechterhalten
können. Insbesondere die Kupffer-Zellen der Leber sowie die Alveolarmakrophagen
scheinen dabei eine wichtige Rolle zu spielen (Abbildung 5). Weitere
Faktoren sind die Alkalisierung des Magen-pH-Wertes und die intestinale
Motilitätsstörung. Dieses pathophysiologische Konzept unterstreicht
die Bedeutung des Darmes als Schlüsselorgan im Rahmen eines MOV
und die Notwendigkeit einer frühen und gezielten enteralen Ernährung
in der Prävention von schweren Komplikationen [25].
Neben der lokalen unspezifischen und spezifischen Abwehr wurde neuerdings auch der Begriff der „angeborenen Abwehr“ (innate immunity) geprägt. Er umschreibt eine vermutlich angeborene oder in der frühen Entwicklung erworbene Immunität, die durch so genannte toll-like-receptors (TLRs) an der Oberfläche von Makrophagen vermittelt wird, welche gegen Oberflächenstrukturen von pathogenen Keimen (pathogen associated molecular patterns, PAMPs) gerichtet sind. Die Aktivierung dieser Rezeptoren führt zur Transkription von Genabschnitten, die nicht nur in die Aktivierung des Immunsystems (Freisetzung von Zytokinen und Mediatoren) involviert sind, sondern auch zur Bildung von Substanzen mit direkter antimikrobieller Wirkung führen. Die Komplexität dieses „toll-like-receptor“-Systems, welches eine zentrale Rolle in der Erkennung von Oberflächenstrukturen pathogener Erreger spielt, ist derzeit Gegenstand intensiver Forschung und wird wahrscheinlich in Zukunft ein wesentlicher Baustein im Verständnis der Interaktion zwischen Mikroorganismen und Wirt darstellen [26]. Die im Rahmen einer Sepsis freigesetzten Entzündungsmediatoren haben spezifische Wirkung im Intermediärstoffwechsel. TNF-a führt zu einem deutlichen Ansteigen der Plasma-Triglycerid-Konzentrationen sowie zur Steigerung der Proteolyse zugunsten der Synthese von Akutphase-Proteinen und Glukose; Stresshormone und Zytokine sind wichtige Katalysatoren kataboler Stoffwechselvorgänge mit konsekutiver Erhöhung des Ruheumsatzes. Mangelernährung und fehlende enterale Ernährung wirken sich begünstigend auf die bakterielle Translokation aus. Weitere translokationsfördernde Effekte sind intestinale Fehlbesiedelung von primär sterilen Darmabschnitten (Dünndarm, Duodenum) mit einer Laktose-Intoleranz, Fettmalabsorption durch Dekonjugation von Gallensäuren, Entstehung von biogenen Aminen und Toxinen, Entwicklung eines intestinalen Ödems als Folge fehlender trophischer Substanzen, ein Perfusionsdefizit mit intermittierender Stase im Splanchnikusbereich und eine generelle Hypoalbuminämie. Die Bedeutung von immunmodulierenden und trophischen Substanzen als Zusatz zur frühen enteralen Ernährung wird bei der Betreuung von Risikopatienten zunehmend anerkannt und klinisch umgesetzt. Die bakterielle Translokationsrate konnte durch Glutamin in einem Enterokolitis-Modell signifikant reduziert werden. Bilanzuntersuchungen während kataboler Zustände zeigten, dass es zu einer Umverteilung von Glutamin aus der Muskulatur in den Intestinalbereich kommt, um den gesteigerten Bedarf in Stresszuständen zu sichern. Glutamin ist aufgrund der mangelnden Stabilität in den üblichen parenteralen Aminosäurelösungen nicht enthalten. Gleiches gilt für Arginin, welches neben seiner Funktion als Proteinbaustein immunmodulatorische Eigenschaften wie eine Steigerung der Lymphozyten-Blastogenese nach Antigenkontakt mit Concanavalin A und Phytohämagglutinin, besitzt [27]. Kurzkettige Fettsäuren stellen als bakterielle Abbauprodukte von Ballaststoffen wichtige oxidative Substrate des Kolons dar und haben außerdem einen trophischen Effekt auf die Mukosa des Dünn- und Dickdarms. Durch Omega-3-Fettsäuren wird die Zytokinproduktion beeinflusst und in vitro die durch Endotoxin induzierte Produktion von TNF und IL-1 aus Monozyten gehemmt [28, 29]. Somit ist es möglich, durch Zusatz der genannten Verbindungen zu enteralen Ernährungslösungen Einfluss auf metabolische und immunologische Parameter auszuüben. Eine wesentliche Voraussetzung für den Einsatz dieser Methode beim kritisch kranken Patienten ist jedoch eine adäquate intestinale Perfusion, die nicht zwingend gegeben sein muss. Ein weiterer Ansatzpunkt in der Prävention von bakterieller Translokation ist die Erhaltung bzw. die Wiederherstellung des ökologischen Gleichgewichtes in der Darmflora. Die sehr häufig durch antibiotische Therapie oder Polychemotherapie vorgeschädigte Darmflora von kritisch kranken Patienten führt zu einer verminderten lokalen Abwehrlage und erhöht das Risiko einer endogenen Infektion. Präbiotika und Probiotika werden in der letzten Zeit sehr proklamiert [30], sind allerdings bei immunsupprimierten Patienten nicht bedenkenlos einsetzbar, da Einzelfälle über septische Geschehen mit Erregernachweis von Lactobacillus acidophilus, Bifidobakterien und Saccharomyces Boulardi berichtet werden [z.B. 31]. Ein völlig neues und viel versprechendes
Konzept stellt die Blockierung der Adhärenz von pathogenen und fakultativ
pathogenen Keimen an der Darmschleimhaut dar. Dabei wird ein seit
langem bestehendes therapeutisches Konzept aufgegriffen, welches
sich bereits in der Behandlung von Durchfallerkrankungen bewährt
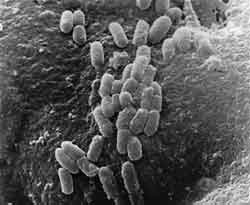
hat. Darmpathogene Keime haften über bestimmte Kohlenhydratstrukturen
an der Oberfläche von Enterozyten [32] und entziehen sich dadurch
der mechanischen Clearance (Abbildung 6). Durch diese initiale Adhärenz
kommt es zu einer komplexen Interaktion zwischen Bakterien und Zelle,
die zu ultrastrukturellen Veränderungen auf beiden Seiten führen
kann. Die Folge ist eine feste Bindung zwischen Bakterien und Mucosazelle
als Vorstufe zur Translokation und Invasivität und wird als bedeutender
Virulenzfaktor äquivalent zur Toxin-Produktion beschrieben.
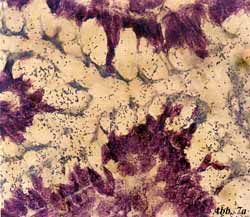
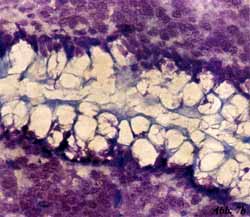
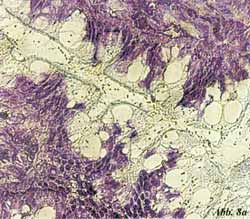
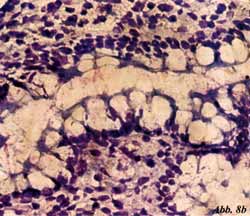
Eigene Untersuchungen haben gezeigt,
dass durch spezifische Oligosaccharide aus natürlichen Quellen (z.B.
Apfelpektine, Karottenpektine, Orangenpektine) die initiale Haftung
von pathogenen Darmbakterien an Oberflächenstrukturen von intestinalen
Epithelzellen blockiert werden kann [33] (Abbildung 7, Abbildung
8). Die an Gefrierschnitten von humanen Darmabschnitten (terminales
Ileum, Jejunum, Colon u.a.) durchgeführten Untersuchungen umfassten
ein breites Spektrum von darmpathogenen Keimen wie enterohämorrhagische
E. coli (EHEC), enteropathogene E. coli (EPEC), enterotoxische
E. coli (ETEC), Salmonella typhi, Salmonella enteritidis,
Klebsiella oxytoca und Enterobacter cloacae. Die klinischen
Isolate zeigten ein jeweils typisches Adhärenzmuster an den Epithelzellen
der Enterozyten und konnten durch saure Oligosaccharide mit Galakturonsäure
als zentrales Zuckermole- kül und einer Kettenlänge von 3-5 Zuckern
in einer Konzentration von 0,5-1% (w/v) zum Teil vollständig blockiert
werden. Diese Oligosaccharide wurden in Zusammenarbeit mit dem Institut
für Pharmakognosie der Universität Wien isoliert und strukturell
aufgeklärt [34]. Das Wirkprinzip beruht sehr wahrscheinlich auf
der Absättigung bakterieller Oberflächenstrukturen durch Rezeptoranaloga
in Form der Oligosaccharid-Liganden. Dabei scheint die Stereokonfiguration
der Zuckerstrukturen an der Oberfläche der Zelle eine wesentliche
Rolle für Spezifität und Selektivität der Bindung einzunehmen. Die
Unterschiede in den adhärenzblockierenden Eigenschaften der getesteten
biogenen Zucker könnte demnach eher an der räumlichen Anordnung
als an den monomeren Untereinheiten liegen. Da die Stereochemie
durch die pflanzliche Biosynthese vorgegeben ist, bietet die Nutzung
herkömmlicher Pektin-Quellen einen interessanten Ansatzpunkt in
der Entwicklung neuer dietätischer Mittel, die nicht zuletzt therapeutisch
und präventiv bei Patienten mit einem hohen Risiko, an den Folgen
einer bakteriellen Fehlbesiedelung und Translokation zu erkranken,
eingesetzt werden können.
Im Tierversuch konnte bereits bewiesen werden, dass ähnliche Verbindungen zur Prävention von Spezies-spezifischen Infektionen in der Aufzucht von Ferkeln und Hühnern geeignet und den meisten Antibiotika in der Tiermast sogar überlegen sind [35, 36]. Weiters konnte in ersten Versuchen an IL-6-knock-out-Mäusen ein präventiver Effekt von sauren Oligosacchariden bei der Verhinderung der Translokation von enteropathogenen Keimen in die mesenterialen Lymphknoten verzeichnet werden. Inwieweit diese Beobachtungen auch auf den Menschen übertragbar sind, soll nun in einer ersten klinischen Studie an intensivgepflegten erwachsenen Patienten geprüft werden. Die Möglichkeit, in einen ganz initialen und wesentlichen Schritt der Pathogenese bakterieller Translokation einzugreifen, bietet für die Zukunft eine große Chance, im Bereich der Prävention mikrobieller Infektionen und ihrer Komplikationen voranzukommen. Dieses therapeutische Konzept könnte einen wesentlichen Beitrag zur Prävention und Behandlung der Sepsis leisten und auch weitere innovative Optionen in der Therapie gastrointestinaler Infekte eröffnen. Ähnliche, bereits in der Muttermilch vorliegende, allerdings nicht saure Oligosaccharide spielen in der Entwicklung der lokalen Immunität des Säuglings eine wesentliche Rolle. Obwohl bislang noch viele Fragen bezüglich der Vorgänge bakterieller Adhärenz und ultrastruktureller Wechselwirkungen zwischen menschlicher Schleimhaut und mikrobieller Besiedelung offen bleiben, hat uns die Natur möglicherweise den richtigen Weg vorgegeben, den es in Zukunft weiter zu beleuchten und verfolgen gilt. |
|
| Anschrift des Verfassers:
Univ.-Prof. Dr. J. Peter Guggenbichler Klinik mit Poliklinik der Universität Erlangen-Nürnberg D-91054 Erlangen, Loschgestraße 15 E-Mail: prof.guggenbichler@iname.com |