| Vancomycin-abhängige Enterokokken |
| A. Mellmann, M.P.
Dierich, F. Allerberger Institut für Hygiene und Sozialmedizin der Universität Innsbruck (Vorstand: o. Univ.-Prof. Dr. M.P. Dierich) |
|
|
| Schlüsselwörter:
Enterokokken, Vancomycin, resistent, abhängig |
Zusammenfassung Wir untersuchten das Vorkommen von Vancomycin-abhängigen Enterokokken bei Patienten unter Vancomycintherapie. Patienten, die zum Zeitpunkt der Probengewinnung oder bis zu 7 Tage zuvor eine p.o. oder i.v. Therapie mit Vancomycin erhielten, wurden in die Studie inkludiert. Von 28 ICU-Patienten (männlich 21) wurden 32 Stuhlproben und 42 Rektalabstriche in BHI-Bouillon mit 4 µg/ml Cefodizim plus jeweils 16 und 64 µg/ml Vancomycin bei 37°C über 24 h angereichert. Davon wurden 10 µl auf antibiotikasupplementiertem (Konzentrationen siehe BHI) Enterococcosel® Agar subkultiviert. Stuhlproben oder Rektalabstriche wurden pro Patient im Abstand von mindestens 3 Tagen zwischen den einzelnen Proben gesammelt. Vancomycin-abhängige Enterokokken wurden nicht nachgewiesen. Aus 4 der 74 Proben (5,4%) wurden Vancomycin-resistente E. faecium isoliert. Der Einsatz von Cephalosporinen der 3. Generation bestätigte sich als Selektionsfaktor für VRE: Während nur 36 von 70 der VRE-negativen Patientenproben unter/nach einer Cephalosporintherapie gewonnen wurden, war dies in 3 von 4 der VRE-positiven Patientenproben der Fall. Ein routinemäßiges Screening auf VDE scheint uns derzeit in Österreich nicht erforderlich. Lediglich bei VRE-Trägern sollten septische Episoden ohne Erregernachweis Anlass geben, mittels Vancomycin-haltiger Nährmedien auf VDE zu untersuchen. |
Key-words: Enterococci, vancomycin, resistant, dependent |
Summary Enterococci that require vancomycin in media for growth, vancomycin-dependent enterococci (VDE), have recently been reported to cause clinically significant infections. We examined the occurrence of VDE at ICUs of the University hospital in Innsbruck (1.507 beds) in patients undergoing vancomycin therapy within the 7 days before specimen collection. From 28 ICU-patients (male 21) 32 stool specimens and 42 rectal swabs were collected and cultured in BHI-broth (supplemented with 4 µg/ml cefodizime plus 16 or 64 µg/ml vancomycin each) overnight in ambient atmosphere. Thereafter, 10 µl aliquots were subcultured into Enterococcosel® Agar (supplemented with antibiotics as mentioned above). No vancomycin-dependent enterococci were detected. From 74 samples 4 (5,4%) vancomycin-resistant E. faecium were isolated. The use of broad-spectrum cephalosporins predisposed for VRE-colonization: Only 36 of 70 VRE-negative samples but 3 of 4 VRE-positive samples were gained during or after broad-spectrum cephalosporin therapy. We do not see a need to screen routinely for VDE in Austria at this time. Vancomycin containing media should be used for primary culture of specimens from unclear septic patients who are known carriers of VRE. |
Einleitung Infektionen mit Enterokokken betreffen meist Patienten mit einem geschwächten Immunsystem. In den USA zeichnen sie für 10-14% aller nosokomialen Infektionen verantwortlich [3]. In Deutschland verursachen Enterokokken 14,7% aller nosokomialen Infektionen [16]. Zur Gattung Enterococcus werden gegenwärtig 17 Spezien gezählt [5]. Unter allen klinischen Enterokokkenisolaten sind 80-90% E. faecalis und 10-20% E. faecium zuzurechnen. Andere Spezien werden in klinischem Untersuchungsmaterial nur selten nachgewiesen [13]. Das Auftreten von Vancomycin-resistenten Enterokokken (VRE) brachte neue therapeutische Probleme. In Österreich wurden VRE erstmalig 1992 beschrieben [2]. Im Jahr 1997 konnten VRE bereits an allen Universitätskliniken Österreichs nachgewiesen werden [1]. Mellmann et al. haben darauf hingewiesen, dass in Tirol VRE im Umfeld von Krankenhäusern, nicht aber bei der gesunden Bevölkerung zu finden sind; 5,8% der an der Universitätsklinik in Innsbruck Hospitalisierten waren in deren Studie Träger von VRE oder VRE-infiziert [15]. 1993 wurde erstmalig das Vorkommen von Vancomycin-abhängigen VRE beschrieben [7, 11]. Diese Enterokokken-Stämme sind Vancomycin-resistent und benötigen zudem für ihr Wachstum Vancomycin. Ständiger Selektionsdruck durch Einsatz von Vancomycin wird als Voraussetzung für das Auftreten von VDE postuliert [4]. Ziel unserer Studie war es zu klären, ob VDE an den Universitätskliniken in Innsbruck bei Patienten mit Vancomycintherapie vorkommen. Nach unserem Wissen war dies in Österreich der erste Versuch, gezielt das Vorkommen von VDE zu untersuchen. |
|
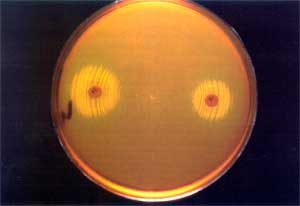
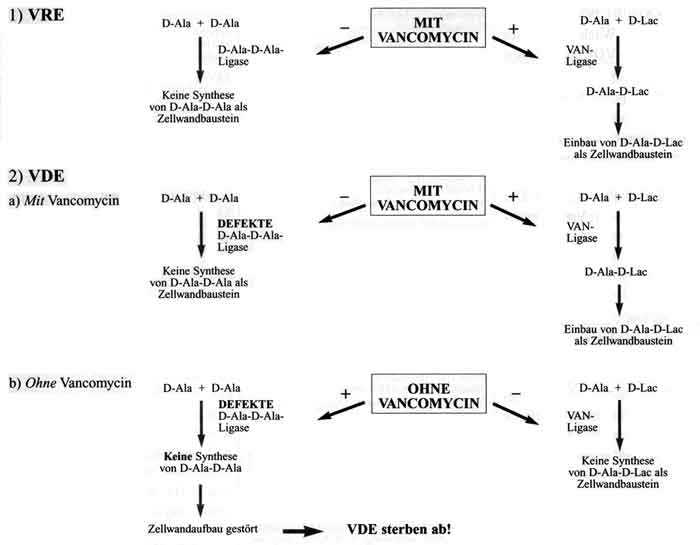
Die klinische Relevanz dieser Erreger steht seit ihrer Entdeckung im Mittelpunkt lebhafter Diskussion. So sehen Farrag et al. in VDE eine Gefahr für Patienten unter Vancomycintherapie. Der steigende Einsatz von Vancomycin unterstützt die Entwicklung von VRE, die die Grundlage für VDE bilden. Zu dem Resistenzproblem kommt die Schwierigkeit des Nachweises: VDE werden im Routinelabor, sofern nicht speziell nach ihnen gesucht wird, nicht nachgewiesen. So stellen Farrag et al. die Frage: "Have we at last witnessed the emergence of a true superbug?" [6]. Woodford et al. bewerten VDE ähnlich: Auf Stationen mit bereits bestehenden VRE-Problemen und bei Patienten mit lang andauernder Vancomycintherapie könnten sich bevorzugt VDE entwickeln. Sie empfehlen bei septischen Patienten mit wiederholt negativen Blutkulturen auch Vancomycin-haltige Nährmedien zu verwenden [25]. Rossney et al. nehmen an, daß VDE wahrscheinlich weiter verbreitet sind, als es die singulären Publikationen vermuten lassen; sie begründen das seltene Auftreten von VDE damit, dass ihr Nachweis mit Routinemaßnahmen im Labor nicht gelingt – nur durch Vancomycin-haltige Nährmedien lassen sich VDE sicher nachweisen, da in den Proben selbst meist nicht genug Vancomycin ist oder dies durch die Probenaufbereitung inaktiviert wird [17]. Auch Dever et al. spekulieren über die Häufigkeit von VDE: Sie meinen, dass VDE zunehmend auftauchen könnten, wenn geeignete Nachweismethoden angewandt würden [4]. Bislang wurden unseres Wissens weltweit nur 13 VDE-Isolate publiziert. Ein Krankheitswert wurde lediglich in 7 Fällen attestiert – die restlichen VDE-Fälle wurden als Kolonisationen gewertet [4, 6, 7, 11, 14, 17, 18, 19, 20, 25]. Die Vancomycinabhängigkeit ist ein außergewöhnliches Beispiel für die extreme Anpassungsfähigkeit von Bakterien an ihre Umweltbedingungen – in diesem Fall an den Selektionsdruck während einer antibiotischen Therapie. In dieser Fähigkeit muss man aber auch die letzte bakterielle Entwicklungsstufe als Antwort auf den Antibiotikaeinsatz sehen. Bedeutet sie auch auf der einen Seite die perfekte Anpassung der Bakterien an ihre Umwelt, wird sie auf der anderen Seite zur „tödlichen Sackgasse“, sobald Vancomycin abgesetzt wird [7, 20, 24]. Die von Dever et al. und Rossney et al. postulierte hohe Dunkelziffer für VDE gab Anlass, mit dieser Studie gezielt nach VDE zu suchen. Dass keine VDE gefunden wurden, bestätigt – zumindest für Österreich – den Ausnahmecharakter des Vorkommens dieser Erreger. Die Häufigkeit VRE-positiver Proben korreliert mit 5,4% gut mit Resultaten früherer Studien: Mellmann et al. fanden 1998/99 VRE in 5,8% der Stuhlproben von ICU-Patienten [15]. Im Rahmen dieser Studie wurden auch die Antibiotika-Anamnesen aller Patienten ausgewertet. Dass die VRE-positiven Proben von Patienten stammen, die signifikant kürzer Vancomycin bekommen hatten (durchschnittlich für 5 Tage) als die Patienten ohne VRE-Kolonisation (Durchschnitt 18,5 Tage), ist bemerkenswert und für uns nicht zu erklären. Der Einsatz von Cephalosporinen der 3. Generation bestätigte sich als Selektionsfaktor für VRE: Während nur 36 von 70 (51,4%) der VRE-negativen Patientenproben unter/nach einer Cephalosporintherapie entnommen wurden, war dies in 3 von 4 (75%) der VRE-positiven Patientenproben der Fall (Risk Ratio „Cephalosporin-Exposition für VRE-positiv“: 2,2 [0,29 < RR < 23,98]). Dieses Ergebnis entspricht den Erfahrungen anderer Autoren, die Breitspektrumcephalosporine als wesentlichen Risikofaktor für VRE-Selektion postuliert hatten [21, 22]. Die geringe Probenzahl unserer Studie gebietet allerdings Vorsicht bei der Interpretation. Der Mechanismus der Vancomycinabhängigkeit scheint aufgeklärt (Abb. 2). Vancomycin induziert bei Vancomycin-abhängigen (= per se auch Vancomycin-resistenten) Enterokokken eine spezielle Enzymkaskade für die Zellwandbiosynthese. Die Vancomycinabhängigkeit hat ihren Ursprung im Resistenzmechanismus gegenüber Vancomycin [9]. Vancomycin hemmt die Zellwandbiosynthese, indem es am terminalen D-Alanyl-D-Alaninrest (D-Ala-D-Ala) des Zellwandprekursors grampositiver Bakterien bindet. Vancomycin-resistente Enterokokken haben einen Stoffwechsel-Bypass entwickelt: Statt D-Ala-D-Ala entsteht ein D-Alanyl-D-Lactatrest durch eine andere Enzymkaskade (Van-Gencluster), oder ein D-Alanin wird enzymatisch abgespalten. In beiden Fällen sinkt die Bindungsaffinität von Vancomycin derart, daß die Enterokokken Vancomycin-resistent werden.
VDE haben wie VRE beide Stoffwechselwege – bei VDE ist aber die D-Ala-D-Ala-Ligase defekt. Solange Vancomycin den Stoffwechsel-Bypass induziert, wird die D-Ala-D-Ala-Ligase nicht genutzt. Fällt die Induktion weg, wird der reguläre Weg über die D-Ala-D-Ala-Ligase genutzt. Ist dieses Enzym wie bei VDE defekt und fehlt die Induktion durch Vancomycin für den Stoffwechsel-Bypass, kann die Zellwandbiosynthese nicht mehr ablaufen. Es fehlen dann sowohl das Dipeptid D-Ala-D-Ala als auch das entsprechende Didepsipeptid der Vancomycin-resistenten Enterokokken (Alanyl-D-Lactat); die Bakterien sterben ab (siehe Abb. 2). Wird D-Ala-D-Ala in vitro als Wachstumsfaktor gegeben, können VDE auch ohne Vancomycinzusatz wachsen [9]. Inwieweit das schlichte Absetzen einer Vancomycintherapie für die Behandlung einer VDE-Infektion genügt, wird in Ermangelung ausreichender klinischer Erfahrungen kontrovers diskutiert [9, 11, 15]. Das rasche Auftreten von Vancomycin-unabhängigen Revertanten in vitro spricht gegen den Erfolg eines simplen Vancomycin-Absetzens als Behandlung von VDE-Infektionen [23]. Der Nachweis von VDE in klinischem Probenmaterial ist als eine Herausforderung für das klinisch-mikrobiologische Labor zu werten [8]. Trotz gezielten Suchens konnten wir bei Patienten unter Vancomycintherapie an Intensivstationen der Innsbrucker Universitätskliniken keine VDE nachweisen. Nach Dever et al. sollte man bei septischen Patienten unter Vancomycintherapie, bei denen kein Erreger gefunden werden kann, auch an die Möglichkeit von VDE denken [4]. Ein routinemäßiges Screening auf VDE scheint uns derzeit in Österreich jedoch nicht erforderlich. Lediglich bei VRE-Trägern sollten septische Episoden ohne Erregernachweis Anlass geben, mittels Vancomycin-haltiger Nährmedien auf VDE zu untersuchen. |
| Literatur:
1.
Allerberger F., Lass-Flörl C., Dierich M.P., Hirschl A., Presterl
E., Haas G., Klare I., Witte W.: „Vancomycin-resistente Enterokokken
in Österreich.“ Wien. Klin. Wochenschr. 109 (1997) 312-320. |
| Anschrift
des Verfassers: Univ.-Prof. Dr. F. Allerberger Institut für Hygiene und Sozialmedizin der Universität Innsbruck A-6020 Innsbruck, Fritz Pregl-Strasse 3 |