| Nosokomiale
Infektionen in der Intensivmedizin - Inzidenz und Diagnose |
| J.P. Guggenbichler
Univ.-Klinik für Kinder und Jugendliche der Universität
Erlangen/Nürnberg
(Vorstand: Univ.-Prof. Dr. W. Rascher) |
Schlüsselwörter:
Nosokomiale Infektion,
verminderte körpereigene Abwehr, implantierbare Fremdkörper,
multiresistente Mikroorgamsmen |
|
Zusammenfassung
Nosokomiale
Infektionen sind ein häufiges Ereignis im Krankenhaus.
Diese Infektionen werden in ca. 75% durch implantierbare Biomaterialien
verursacht. Diese implantierbaren Kunststoffe sind einerseits
in der Intensivmedizin nicht mehr wegzudenken, anderseits sind
sie besonders leicht bakteriell besiedeIbar. Pathomechanismen
sind eine verminderte körpereigene Abwehr und die gute
Haftfähigkeit bakterieller Mikroorganismen und von Pilzen
an Kunststoffen, wo sie von der körpereigenen Abwehr nicht
mehr angreifbar sind. Dadurch sind Fremdkörper-assoziierte
Infektionen mit einer erheblichen Morbidität und Mortalität,
insbesondere in der Kinderheilkunde, verbunden. Präventiven
Maßnahmen ist daher besondere Bedeutung beizumessen.
|
Key-words:
Nosocomial
infections, impaired host defense mechanisms, implantable biomaterials,
multiresistant microorgamsms |
|
Summary
Nosocomial
infections are frequent events in hospitals. Approximately 15%
of patients in intensive care units and 3.5% of patients admitted
to
a regular ward suffer from a hospital acquired infection not
present at the time of admission. These infections result in
approximately 75% of patients from implantable biomaterials.
These foreign bodies e.g. central venous catheters, endotracheal
tubes and transurethral catheters are indispensable in the management
of critically and chronically ill patients, improve the therapeutic
outcome substantially, save human lives and greatly enhance
the quality of life of these patients. At the same time these
plastic devices in use at present are easily colonized with
bacteria and fungi. Multiresistant nosocomial pathogens are
the most common organisms colonizing the outer and inner surface
of these plastic devices. The common pathomechanism of all foreign
body related infections is a decreased bodys defense mechanism
largely due to the inherent disease process leading to the admission
to the hospital and/or concomitant immunosuppressive therapy.
Also the strong adherence of bacteria on plastic surfaces plays
an important role. A thick biofilm is formed within 24 hours
on the entire surface of these plastic devices once inoculated
with a small number of bacteria. Septic infections originating
from these implantable foreign bodies are difficult to diagnose
and great discrepancies exist regarding the true incidence.
These infections result in a substantial morbidity and mortality
particularly at either end of life i.e. in premature and newborn
infants and in the elderly. The treatment of nosocomial infections
puts a large burden on the health budget.
|
Einleitung
Eine im
Krankenhaus erworbene Infektion wird als nosokomiale Infektion
bezeichnet, wenn sie bei der Aufnahme in ein Krankenhaus weder
als Inkubation noch als manifeste Erkrankung besteht [1]. Durch
das Auftreten 48 -72 Stunden nach der Aufnahme lassen sich nosokomiale
Infektionen von ambulant erworbenen (community acquired) Infektionen
weitgehend abgrenzen.
Zwei Schlüsselfaktoren
sind für das Auftreten einer nosokomialen Infektion verantwortlich:
1)
Verminderte körpereigene Abwehr:
Diese besteht bei vielen Patienten bereits auf der Basis ihrer
Grundkrankheit, die zur stationären Aufnahme führt.
Es sind dies Frühgeburtlichkeit oder hohes Alter, MaInutrition,
Fehlbildungen, Tumorerkrankungen und die Verabreichung von Medikamenten
wie Zytostatika, Kortikosteroide, Cyclosporin A, die die körpereigene
Abwehr einschränken. Auch Diabetes mellitus, Alkoholismus,
chronische Lungenerkrankungen beeinträchtigen die körpereigene
Abwehr erheblich [2]. Die körpereigene Abwehr ist nach
einem großen chirurgischen Eingriff, aber auch bei Traumata
und ausgedehnten Brandverletzungen wesentlich eingeschränkt.
Eine Infektion führt durch die Freisetzung von Interleukin
10 und anderen antiinflammatorischen Zytokinen wie Interleukin-Rezeptor-Antagonisten
und TNF-Rezeptoren zu einer Art "Immunparese" und
einem weiteren, wesentlich gesteigerten Risiko für infektiöse
Komplikationen [3]. Gleichzeitig sind auch unspezifische Abwehrmechanismen
wie die mukoziliäre Clearance bei intensivbehandelten Patienten
wesentlich beeinträchtigt. Die Implantation von Fremdmaterial
wie zentralen Venenkathetern, Kathetern zur Harnableitung oder
die endotracheale Intubation umgeht spezifische und unspezifische
Abwehrmechanismen des Körpers und hat zur Folge, dass fakultativ
pathogene Mikroorganismen auch bei intakter Abwehr nur schwer
eliminiert werden können [4].
2)
Besiedlung mit pathogenen oder fakultativ pathogenen Mikroorganismen:
Prinzipiell kann jeder Keim einschließlich apathogener
Mikroorganismen der normalen Flora für eine nosokomiale
Infektion verantwortlich sein. Bei den Mikroorganismen, die
bei einer nosokomialen Infektion isoliert werden, handelt es
sich meist um multiresistente Mikroorganismen wie
MRSA, multipel resistente Enterokokken oder Gram-negative Mikroorganismen
wie P. aeruginosa, Serratia marcescens, Enterobacter
cloacae mit "extended spectrum"-ß-Laktamasen
sowie C. albicans. Überwachungsdaten im SCOPE
(Surveillance and Control of Pathogens of Epidemiologic Importance)-Projekt
zeigten, dass gegenwärtig Gram-positive Mikroorganismen
mit 60% bei nosokomialen Infektionen überwiegen, während
Gram-negative Mikroorganismen nur 27% ausmachen [4]. In der
EPIC-Studie wurden folgende Mikrooganismen nach Häufigkeit
isoliert: S. aureus (30%), Pseudomonas aeruginosa
(29%), Coagulase-negative Staphylokokken (19%), Candida
spp. (17%),
E. coli (13%), Enterokokken (12%), Acinetobacter
(9%) und Klebsiella spp. (8%) [5]. In der Kinderheilkunde
spielen zudem Enterobacter cloacae, z.B. bei Patienten
mit Harnwegsfehlbildungen unter Antibiotikaprophylaxe oder bei
Patienten unter antineoplastischer Behandlung, eine große
Rolle. Auch hier kommt implantierbaren Biomaterialien eine zunehmende
Bedeutung zu, da Mikroorganismen auf Biomaterialien gut haften
und rasch proliferieren [6].
Übertragungswege
Die Übertragungswege
dieser Mikroorganismen bestehen entweder in einer exogenen Kolonisation
durch Kontamination über die Hände des
Personals oder durch kontaminiertes Equipment wie Beatmungsgeräte
und Aerosole [7]. Das Hauptreservoir dieser multiresistenten
Kolonisationskeime ist jedoch die körpereigene Flora im
Oropharynx, im Intestinal- und Urogenitaltrakt. Dabei ist heute
bekannt, dass nicht nur lebende Mikroorganismen, sondern auch
Keimbruchstücke über bakterielle Translokation die
proinflammatorische Entzündungskaskade anheizen und zum
klinischen Bild einer Sepsis, dem Systemic Inflammatory Response
Syndrom (SIRS), jedoch ohne Keimnachweis im Blut, führen
[8]. Sedativa, Antazida zur Stressulkusprophylaxe, Kortikosteroide,
eine vorangegangene Antibiotikatherapie und multiple Bluttransfusionen
wurden als weitere Risikofaktoren identifiziert [9].
Entscheidend
für die Entstehung einer nosokomialen Infektion ist die
Kolonisation von Oberflächen. Das betrifft sowohl die Schleimhäute
als auch die implantierten Biomaterialien. Bei der Behandlung
lebensbedrohlich kranker und chronisch kranker Patienten sind
implantierbare Kunststoffe zur Verbesserung der therapeutischen
Möglichkeiten und zur Steigerung der Lebensqualität
nicht mehr verzichtbar. Sie werden neben vielen anderen Einsatzmöglichkeiten
als nicht tunnelierte zentralvenöse Kurzzeitkatheter bei
intensivgepflegten Patienten und zu Beginn einer Hämodialyse
sowie als tunnelierte Langzeitkatheter bei onkologischen Patienten
zur kontinuierlichen Verabreichung von Infusionslösungen,
Blutprodukten und Medikamenten sowie als endotracheale Tuben,
als Ureterkatheter zur Harnableitung, zur Wunddrainage
oder als Ventrikeldrainagen etc. verwendet.
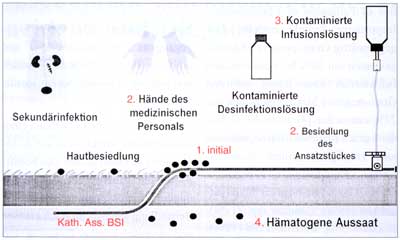
Katheter-assoziierte
Infektionen können auf mehreren Wegen entstehen (Abbildung
1):
1) Bei
der extraluminalen Infektion geht die Kolonisation des Katheters
von der Einstichstelle aus, wobei Mikroorganismen der Hautflora
entlang der Außenseite des Katheters in die Tiefe wandern.
Dieser Infektionsweg besteht vor allem in den ersten Tagen nach
dem Legen des Katheters, insbesondere wenn bei der Implantation
des Katheters nicht größte Asepsis gewahrt wird [10].
2) Der
luminale Infektionsweg gewinnt bei längerer Liegedauer
an Bedeutung, wobei ab dem 5. Liegetag die Majorität der
Katheter, ausgehend vom Luer-Lock, auf der Innenseite besiedelt
werden. Die Mikroorganismen gelangen durch das Konnektionsstück
in das Katheterlumen. Bei tunnelierten, mit Cuff versehenen
Langzeitkathetern vom Hickman-Typ ist dies praktisch der einzige
Infektionsweg [11].
3) Auch
eine Kontamination der Infusionslösung kann als Quelle
einer nosokomialen Katheter-assoziierten Infektion in Frage
kommen. Z.B.
Mischbeutel bei parenteraler Ernährung können bei
der Zubereitung bakteriell kontaminiert werden, wenn sie nicht
in einer Laminar-Flow-Einheit gemischt werden [12]. Das selbe
gilt auch für Tenckhoff-Katheter zur Peritonealdialyse
(CAPD).
4) Letztlich
können auch Mikroorganismen, die sich im Rahmen einer Bakteriämie
oder Sepsis in der Blutbahn befinden, den intravasalen Teil
des Katheters, inbesondere bei Thrombenbildung, besiedeln.
Abbildung
1: Pathogenese der Katheterinfektionen (Widmer
1993)
|
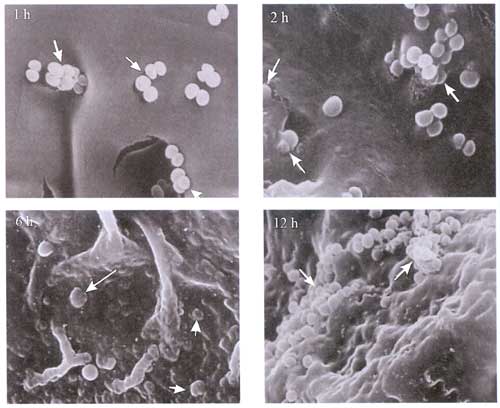
Der Nachteil
bisher benutzter Kunststoffe ist die leichte, aber folgenschwere
Besiedelbarkeit mit Bakterien und Pilzen. Daraus resultieren
einerseits lokale Infektionen an der Eintrittsstelle, aber auch
lebensbedrohliche Komplikationen wie die Katheter-assoziierte
Blutstrominfektion (BSI), eine septische Thrombophlebitis, Endokarditis
und metastatische Infektionen in verschiedenen Organen (Lunge,
Meningen/Gehirn, Knochen, Niere) [13] (Abbildung 2a, b, c, d).
Abbildung
2: Proliferation von Mikroorganismen auf Kunststoffoberflächen
|
|
| Inzidenz
Nosokomiale
Infektionen sind ein häufiges Problem: In einem Unterhausbericht
des englischen Parlaments aus dem Jahr 2000 wird über 100.000
Fälle von nosokomialen Infektionen in Großbritannien
mit mindestens 5.000 Todesfällen berichtet, was zu einem
großen Aufruhr in der
Öffentlichkeit führte [14]. Die Deutsche Ärztezeitung
vom Februar 2004 berichtet, dass nach Angaben des Robert-Koch-lnstitutes
in Deutschland pro Jahr etwa 600.000 Patienten an einer nosokomialen
Infektion erkranken [15]. Dies wurde von der Ärzteschaft
mit Unglauben und Verwunderung ohne weiteren Kommentar registriert.
Die klinische
Diagnose einer nosokomialen, insbesondere einer Katheter-assoziierten
Infektion kann beim multimorbiden Intensivpatienten, nach großen
chirurgischen Eingriffen, Polytrauma, Myokardinfarkt oder Schlaganfall
schwierig sein. Insgesamt hängt die Inzidenz und Letalität
nosokomialer Infektionen von einer Vielzahl von Variablen ab:
Es wurde über Inzidenzraten zwischen 9 und 37% berichtet.
Sie hängen allerdings wesentlich von der Art des Krankenhauses,
der Intensivstation, der Patientenpopulation und den Definitionen,
die man für das Vorliegen einer nosokomialen Infektion
anlegt, ab. Entsprechend der NIDEP (Nosokomiale Infektionen
in Deutschland - Erfassung und Prävention)-Studie mit 15.000
Klinikpatienten aus dem Jahr 1994 infizieren sich bei Klinikaufenthalten
15,3% der Patienten auf Intensivstationen und 3,8% der Patienten
auf chirurgischen Stationen [16]. Nach der Häufigkeit gegliedert
sind es Harnwegsinfekte (40%), Infekte der unteren Luftwege
(20%), Wundinfektionen (15%) und Sepsis (8%). In einer Untersuchung
des National Nosocomial Infection Surveillance (NNIS)-Systems,
bei der die Krankenakten von 498.998 Patienten beurteilt wurden,
sind 83% der nosokomialen Pneumonien mit einem liegenden endotrachealen
Tubus und künstlicher Beatmung, 97% der nosokomialen Harnwegsinfektionen
mit einem Blasen-Nieren- Katheter oder einem Ureterstent und
87% der Fälle von Sepsis mit einem zentralen Venenkatheter
assoziiert [17].
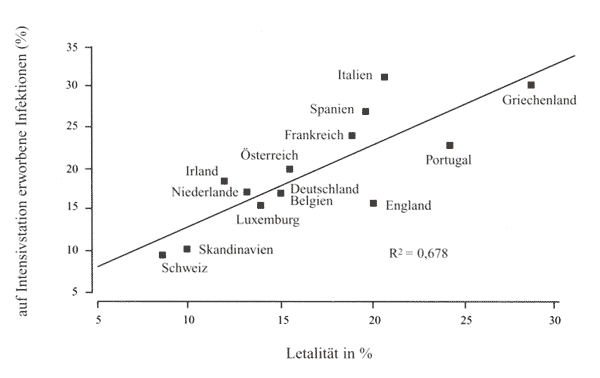
Eine der
größten Datensammlungen bezüglich nosokomialer
Infektionen liegt in der EPIC-Studie aus dem Jahr 1992 vor.
In dieser 1-Tages-Punkt-Analyse wurden aus 2.064 Intensivstationen
in Westeuropa 10.038 Patienten beurteilt. 4.501 Patienten litten
an einer Infektion und 21% davon an einer im Krankenhaus erworbenen
Infektion. Gleichzeitig wurde auch die Prävalenz und die
Letalität nach Ländern beurteilt [5].
Die Inzidenz
hängt auch wesentlich von der Pflegeintensität und
der Qualität präventiver Maßnahmen, wie einer
speziellen hygienischen Ausbildung des Pflegepersonals sowie
strikter Asepsis bei der Pflege der Patienten - insbesondere
der Pflege implantierter Biomaterialien - ab. Ein Faktor, der
sich intensiv auf die Inzidenz nosokomialer Infektionen im Allgemeinen,
insbesondere aber auf die Inzidenz Katheter-assoziierter Infektionen
auswirkt, ist die Pflegeintensität. Bei einer Abnahme der
Pflegeintensität, d.h. bei verminderter Personaldecke,
ist die Rate an Katheter-assoziierten Infektionen um ein Vielfaches
gesteigert [40]. Außerdem bestehen weitere Variable wie
die Anzahl der Manipulationen am Katheteransatz und insbesondere
die Zahl der Blutentnahmen aus dem Katheter [41]. Aber auch
der Transfer auf eine Normalstation hat einen Einfluss, wobei
auf die Diagnose einer Katheter-assoziierten BSI häufig
weniger Augenmerk gelegt wird und Infektionen mit dem gegenwärtigen
Meldesystem auch nicht erfasst werden (Abbildung 3).
Abbildung
3: Korrelation zwischen Prävalenz von auf
Intensivstationen erworbenen Infektionen und der Letalität
nach Ländern [2]
|
In Südeuropa
besteht sowohl eine höhere Inzidenz als auch eine höhere
Letalität im Vergleich zu den skandinavischen Ländern
und der Schweiz. Deutschland und Österreich liegen sowohl
bezüglich Inzidenz als auch Letalität im Mittelfeld.
Nosokomiale
Infektionen sind mit einer wesentlich erhöhten Morbidität,
einer um mindestens 10 Tage verlängerten stationären
Verweildauer und dadurch mit Kosten von ca. 10.000 Euro bis
32.000 $ pro Fall verbunden [18,19]. Je nach verwendeter Definition
wurde eine Letalität zwischen 4 und 25% beschrieben [20,
21]. |
| Spezifische
nosokomiale Infektionen Katheter-assoziierte
Infektionen
Bei der
Beurteilung der Inzidenz Katheter-assoziierter Infektionen bestehen
erhebliche Unterschiede zwischen den publizierten Daten. Seit
1970 wurden durch das NNIS (National
Nosocomial Infection Surveillance)-System
des CDC Daten bezüglich der Inzidenz Fremdkörper-assoziierter
nosokomialer Infektionen in ca. 300 Kliniken in den USA erhoben.
Zwischen 1992 und 2001 berichteten Kliniken, die am NNIS-System
teilnahmen, ZVK-assoziierte Infektionsraten zwischen 2,9/1.000
Kathetertage (auf kardiochirurgischen Intensivstationen) und
11,3 (auf neonatologischen Intensivstationen bei Frühgeborenen
< 1.000 g) pro 1.000 Kathetertage [22].
Das Krankenhaus-Infektions-Surveillance-System
(KISS) erfasste als nationale Referenzdatenbank zwischen 1996
und 2002 Daten von
1.282.564 ZVK-Tagen aus 274 regelmäßig teilnehmenden
Intensivstationen in Deutschland [23]. Dabei wurde ein Mittelwert
bei der Anwendung der CDC-Definitionen von 1,8 Fällen pro
1.000 ZVK-Tage beobachtet. Es bestanden jedoch erhebliche Unterschiede
zwischen den einzelnen Intensivstationen. Die geringste Rate
wurde auf neurochirurgischen Intensivstationen (1,0/1.000 Kathetertage),
die höchste Rate auf pädiatrischen Intensivstationen
(5,5/1.000 Kathetertage) beobachtet. Die statistischen Daten
beruhen jedoch auf einer freiwilligen Meldung des Infektionsgeschehens.
Gleichzeitig wurde jedoch seit 1997 eine erhebliche Zunahme
der Isolate von MRSA auf über 25% nachgewiesen.
Die in
der KISS-Studie (1,7/1.000 Kathetertage) erhobenen Daten liegen
erheblich niedriger als die im NNIS-System für US-amerikanische
interdisziplinäre Intensivstationen ermittelte Rate von
4,5 ZVK-assoziierten BSI pro 1.000 Kathetertage, die nach Analyse
von 600.367 ZVK-Tagen errechnet wurde. Auch in der neuesten
internationalen Literatur wurden erheblich höhere Inzidenzdaten
beschrieben: Safdar und Maki gehen 2002 von einer Rate an Katheter-assoziierten
Infektionen von 5,9 BSI pro 1.000 Kathetertage aus und schätzen
das Auftreten einer ZVK-assoziierten BSI in den USA auf 250.000
Fälle pro Jahr [42]. Donnelli schätzt die Inzidenz
auf über 200.000 Fälle von nosokomialen BSI in den
USA, 90% davon Katheter-assoziiert [43]. Hiramatsu spricht ebenso
von > 200.000 Fällen von Katheter-assoziierten Infektionen
jährlich in den USA [44].
Diese Unterschiede
bedürfen einer Beurteilung bzw. einer Erklärung:
Bei der
Bewertung der Inzidenz der BSI sind zahlreiche Variable wie
Größe und Art der Klinik, Art des zentralen Venenkatheters
(tunneliert
versus nicht tunneliert), Anzahl der Lumina, Art und Schwere
der Grundkrankheit und das Lebensalter zu berücksichtigen.
Ein weiterer wichtiger Parameter ist die Situation, in der ein
Katheter gelegt wurde, d.h. als Notfallkatheter unter limitierten
aseptischen Kautelen oder als elektiver
Eingriff im Operationssaal. Auch Unterschiede in den verwendeten
Definitionen einer Katheter-assoziierten BSI führen zu
erheblichen
Unklarheiten. Der Begriff der Katheter-assoziierten Sepsis ist
in der Fachliteratur mindestens doppelt besetzt, einmal im Sinne
der klinischen Studien zur Sepsis-Prävention (z.B. in randomisierten
klinischen Studien mit imprägnierten Kathetern), anderseits
im Sinne von Surveillance-
Studien [26].
Bei 17
kontrollierten, randomisierten prospektiven Vergleichsstudien
eines antimikrobiell ausgestatteten Katheters mit einem unbehandelten
Kontrollkatheter entsprach keiner der Kontrollkatheter der Inzidenz
im Rahmen der RKI-Daten. Bei 2 Studien lag die Inzidenz beim
Kontrollkatheter mit 2,1 und 2,6 BSI/1.000 Kathetertage in der
Größenordnung der KISS- bzw. NNIS-Daten. In 15 Studien
wurde bei Kontrollkathetern eine erheblich höhere Inzidenz,
die zwischen 3,8 und 14,2/1.000 Kathetertage liegt, beobachtet
(Tabelle 1) [47].
In einer
eigenen multizentrischen Studie unter Verwendung eines mit Nanosilber
antimikrobiell ausgestatteten Katheters ergab sich bei einer
durchschnittlichen Liegedauer von 12,2 Tagen bei insgesamt 294
Patienten mit einem Kontrollkatheter eine Rate an BSI von 12,2%
[42].
Tabelle
1: Infektionsrate von Kontrollkathetern im Rahmen
kontrollierter Studien ohne antimikrobiell ausgestattete
Vergleichskatheter
| Autor |
Patienten-
anzahl |
Liegedauer
in Tagen |
Infektionsrate
in % |
|
| Tennenberg |
145 |
5,3 |
6,2 |
| Maki |
195 |
6,0 |
4,6 |
| Hannan |
60 |
8,0 |
7,0 |
| Bach |
117 |
7,7 |
2,6 |
| Heard |
157 |
9,0 |
3,8 |
| Collin |
139 |
7,3 |
2,9 |
| Ciresi |
127 |
9,1 |
11,7 |
| Pemberton |
40 |
11 |
7,5 |
| Trazzera |
99 |
6,7 |
5,1 |
| George |
35 |
-- |
8,6 |
| Karthaus |
55 |
16 |
14,2 |
| Ranuci |
100 |
8 |
5,5 |
| Corral |
104 |
13 |
4,0 |
| Raad |
151 |
6,0 |
5,0 |
| Böswald* |
86 |
12,0 |
14,5 |
| Böswald* |
226 |
12,5 |
12,2 |
| Ramsay |
189 |
10,9 |
2,1 |
|
| * gesicherte und wahrscheinliche
Katheter-assoziierte Infektionen |
|
Patientenbezogene
Variable
Altersabhängigkeit
Besonders auffällig ist die Altersabhängigkeit von
Katheter-assoziierten Infektionen: Bei pädiatrischen Intensivstationen
wurde ein Mittelwert von 5,5/1.000 Kathetertage mit einer Streubreite
zwischen 3,6/1.000 (25%) und 10,3/1.000 Kathetertage (75 Perzentile)
gefunden [24].
Gemäß
NNIS-Bericht vom Januar 1992 bis Juli 2002 wurde auf 74 pädiatrischen
Intensivstationen in den USA ein Mittelwert von 7,4/1.000
Kathetertage mit einer Variation zwischen 1,3 (10%) und 11,9
(90%) erhoben [25, 26]. Eine weitere Erhebung von nosokomialen
Infektionen
in 50 pädiatrischen Intensivstationen in den USA ergab
einen Mittelwert von 8,6 BSI pro 1.000 Kathetertage [27]. Die
höchsten Raten wurden bei Nabelvenen- oder -arterienkathetern
bei Frühgeborenen < 1.000 g mit 12,8/10.000 Kathetertage
beobachtet.
Eine Übersicht ZVK-assoziierter Infektionen auf pädiatrischen
Intensivstationen in Spanien ergab eine Rate an Katheter-assoziierten
BSI von ebenfalls 12,8/1.000 Kathetertage [28]. Auch eine erhöhte
Prävalenz von BSI bei peripheren Venenkathetern wurde bei
Säuglingen und Kleinkindern beobachtet.
Grundkrankheit
Eine überproportional höhere Rate an Infektionen wurde
bei Erwachsenen mit bestimmten Grundkrankheiten nachgewiesen.
Die Rate an ZVK-
assoziierten Infektionen bei schwer Brandverletzten beträgt
12% [29]. Eine erhebliche Steigerung der Rate ZVK-assoziierter
Infektionen besteht
bei Kurzdarmsyndrom, malignen Tumoren und Leukämie, zystischer
Fibrose, spezifischen Immundefekten und Neutropenie sowie nach
Verabreichung von Medikamenten (Zytostatika, Kortikosteroide)
und Infusionslösungen (Lipide) [30]. Karthaus berichtet
über eine Rate ZVK-assoziierter Infektionen von 15% bei
Tumorpatienten mit einer durchschnittlichen Liegedauer von 16
Tagen. In einer weiteren kontrollierten, randomisierten Studie
wurde bei einer durchschnittlichen Liegedauer von 12 Tagen bei
3 Lumenkathetern über eine Häufigkeit von Katheter-assoziierten
BSI zwischen 12% und 14% Prozent berichtet [32].
Liegedauer
Ein wesentlicher Einflussfaktor für Katheter-assoziierte
BSI ist die Liegedauer der Katheter. Bei zunehmender Liegedauer
nimmt die Rate an septischen Komplikationen, ausgehend vom Katheter,
überproportional zu. Milliken korrelierte die Rate an Infektionen
mit der Liegedauer der Katheter für Neugeborene (Tabelle
2) [31].
Tabelle
2: Liegedauer der Katheter und Prozentsatz der
Patienten mit behandlungsbedürftigen BSI [31]
| Liegedauer |
Nabelvenenkatheter |
Nabelarterienkatheter |
|
| 1
- 6 Tage |
2,8 % |
2,7 % |
| 7
- 13 Tage |
9,8
% |
9,3
% |
| 14
- 20 Tage |
8,2
% |
21,2
% |
| 21
- 27 Tage |
62,5
% |
47,4
% |
| 28
- 34 Tage |
83,3
% |
100,0
% |
|
|
Sheldonkatheter,
die in den ersten Wochen einer Hämodialyse üblicherweise
als Jugulariskatheter gelegt werden, haben eine besonders hohe
Inzidenz Katheter-assoziierter Infektionen. 14% bis 36% aller
Patienten erkranken daran [33].
Bei langzeitimplantierten,
tunnelierten, mit Cuff versehenen Hickman-, Broviac-Type-Kathetem
wurde eine Infektionsrate von 0,7- 1,2 BSI pro
1.000 Kathetertage nachgewiesen. Nachdem diese Katheter jedoch
generell ca. 250 Tage liegen, kommt es bei einem von 4 Patienten
mit einem Hickman-Katheter zu einer Katheter-assoziierten BSI,
was einer Rate von ca. 25% entspricht [34,35]. Die Erfassung
nosokomialer Infektionen bei Einsatz von Hickman-Kathetern an
pädiatrisch-onkologischen Patienten in Deutschland ergab
eine Rate von 1,93 Infektionen pro 1.000 Kathetertage und Infektionen
bei 48% der Patienten. Diese Ergebnisse, die in der Literatur
sowohl für Kinder als auch Erwachsene beschrieben werden,
wurden an unserer Klinik in einer prospektiven Untersuchung
bestätigt [36].
Bei subkutan
implantierten Port-Kathetern wird eine Infektionsrate von 8
-12% beschrieben, von denen 80% als intraluminale Infektion,
10%
als Infektion der Außenseite und 10% als kombinierte intraluminale
und Oberflächen-Infektionen auftreten [37, 38].
Über
den Einfluss peripherer Venenkatheter existieren wenige kontrollierte
Studien. Vor allem wurde septischen Komplikationen wegen der
kurzen Liegedauer und dem häufigen Wechsel der Punktionsstelle
bisher wenig Bedeutung beigemessen. Da diese peripheren Venenverweilkatheter
meist nicht unter strengen aseptischen Kautelen (sterile Handschuhe,
Maske, Haube) gelegt werden, ist die Phlebitisinzidenz jedoch
erheblich. In einer prospektiven Untersuchung von 412 peripheren
Venenkathetern bei 175 Patienten wurde bei einer durchschnittlichen
Liegedauer eine Häufigkeit von Thrombophlebitiden, die
regelmäßig durch Mikroorganismen besiedelt waren,
von 12,8% beschrieben [39]. In einer Studie aus der Türkei
wird von eine Phlebitis-Rate von 36% berichtet, wobei ein Teflonkatheter
mit 48% Phlebitisrate wesentlich schlechtere Ergebnisse erbrachte
im Vergleich zu einem Vialon-Katheter. Auch bei Säuglingen
und Kleinkindern ist die Rate an thrombosierten und infizierten
peripheren Venenkathetern hoch, dafür sind allerdings keine
verlässlichen Zahlen verfügbar [40].
Klinische
Diagnose, Datenerhebung/Falldefinition
Symptome
1) Fieber
(> 38°C) oder Schüttelfrost oder Hypotonie
2) Kultureller
Nachweis von pathogenen Erregern im Blut, welche nicht mit Infektionen
an anderer Stelle assoziiert sind. Für eine Katheter-
assoziierte Sepsis mit Erregernachweis gilt die Ausnahme, dass
auch dann eine Katheter-assoziierte Infektion vorliegt, wenn
keine lokalen
Infektionszeichen an der Kathetereintrittsstelle ersichtlich
sind [45].
3) Gewöhnlicher
Hautkeim, der aus mindestens 2 zu verschiedenen Zeiten entnommenen
Blutkulturen isoliert wird.
4) Gewöhnlicher
Hautkeim, der in mindestens einer Blutkultur isoliert wird,
auch wenn eine entsprechende antimikrobielle Therapie begonnen
wird.
5) Jede
primäre Sepsis wird als Katheter-assoziierte Sepsis betrachtet,
wenn innerhalb von 48 Stunden vor Beginn der klinischen Symptomatik,
die auf eine Sepsis hinweist, ein zentraler Venenkatheter in
Gebrauch war.
6) Ein
starker Hinweis auf eine Katheter-assoziierte Infektion besteht
dann, wenn keine anderen lokalen oder peripheren Entzündungsherde
gefunden werden.
Ad 1) Die
Leitsymptome Fieber und Hypotonie/Oligurie werden auch durch
eine Reihe anderer Ursachen wie eine Pneumonie, eine Harnwegsinfektion,
eine Wundinfektion oder eine Thrombophlebitis verursacht. Dieselben
Symptome können aber auch als Resorptions- oder Durstfieber
bei verminderter Flüssigkeitszufuhr bestehen. Außerdem
kommen Fremdkörper wie Beatmungstubus, Drainagen, Blasenkatheter
oder periphere Verweilkanülen als weitere Infektionsquellen
für dieses Krankheitsbild in Frage und führen zu falsch
positiven Resultaten.
Ad 2,3,4)
Der Nachweis des gleichen Keimes in mehreren Blutkulturen, die
aus zwei verschiedenen Stellen (mindestens 2-mal aus dem Katheter,
1-mal aus einer peripheren Entnahmestelle) und zu unterschiedlichen
Zeiten (30 Minuten Abstand) abgenommen werden, gibt einen Hinweis,
benötigt aber Zeit. Üblicherweise wird bei Mehrlumenkathetern
die Blutkultur aus dem Hauptlumen abgenommen, da sich die Abnahme
aus einem kleineren Lumen - z.B. durch die Katecholamine zur
Kreislauferhaltung - mit einer niedrigen Durchflussrate schwieriger
gestaltet. Für einen gesicherten Nachweis einer Katheter-assoziierten
Sepsis ist es jedoch nötig, dass bei einem Multilumen-Katheter
aus jedem Lumen eine Blutkultur entnommen wird, da gerade in
den Lumina mit langsamer Durchflussrate oder den stillgelegten
Lumina leichter
Keime proliferieren. Zudem begünstigen Katecholamine wie
Dopamin die Proliferation und Biofilmbildung von Mikroorganismen.
Dabei ist zu betonen, dass ab dem 5. Liegetag eine Infektion,
ausgehend vom Luer-Lock, insbesondere bei ständigen Manipulationen
vorzugsweise im Lumen vorliegt [46].
Es ist
festzuhalten, dass nicht zuletzt wegen des geringen Anteils
an mikrobiologisch bestätigten BSI die für Deutschland
nach der KISS-Surveillance ermittelte Rate als Mindestwert der
ZVK-assoziierten BSI-Rate aufzufassen ist, da häufig bei
Fieber ein zentraler Venenkatheter entfernt wird
und keine weitere mikrobiologische Untersuchung des explantierten
Katheters erfolgt. Damit ist keine lückenlose statistische
Erfassung Katheter-assoziierter Infektionen möglich.
Andererseits
kann eine falsch negative Beurteilung, z.B. durch eine negative
Blutkultur oder eine klinische Besserung nach Entfernung des
Katheters, aufgrund einer begonnenen oder gleichzeitig geänderten
Antibiotikatherapie bedingt sein.
Score-System
Zur
Beurteilung der Wirksamkeit nach klinischen praxisorientierten
Gesichtspunkten wurde an unserer Klinik ein Score-System entwickelt,
das auf den HICPAC-Definitionen aufbaut und die quantitative
Abschätzung des kausalen Zusammenhangs zwischen dem klinischen
Bild und einer möglichen oder bewiesenen Katheterinfektion
erlaubt. Es beinhaltet als Diagnosekriterien neben Entzündungszeichen
der Kathetereintrittsstelle Höhe und Anstieg von Fieber,
Schüttelfrost, Keimnachweis in der zentral und peripher
gewonnenen Blutkultur bzw. einen früheren Keimnachweis
in der zentralen Blutkultur und in der peripheren Kultur, Besserung
des klinischen Bildes in unmittelbarem Zusammenhang mit der
Entfernung des Katheters und das Fehlen eines anderen Infektionsherdes.
Dabei ist zu betonen, dass auch für eine klinische Besserung
nach Katheterentfernung mit gleichzeitigem Beginn einer Antibiotikatherapie
oder -umstellung für nicht erhobene Blutkulturen oder unter
einer Antibiotikatherapie (Neubeginn oder Umstellung) erhobene
negative Blutkulturen ein bestimmter Punktewert vergeben wird.
Zudem werden die Katheter nach Explantation mikrobiologisch
mittels Ausrollkultur und nach Sherertz untersucht. Diese Kriterien
werden, je nach Vorliegen und Ausprägung eingestuft, mit
Punktewerten versehen und entsprechend ihrer Spezifität
gewichtet. Der Vergleich der Resultate des Bewertungsscores
mit den Diagnosekriterien der HICPAC-Empfehlungen bei 65 Patienten
mit gesicherten Katheter-assoziierten Infektionen ergab eine
Konkordanz von 85%. Kein Fall wurde falsch negativ bewertet,
bei 9 von 10 falsch positiv bewerteten Patienten sprachen weitere
klinische Befunde für eine Katheter-assoziierte Infektion.
Der Bewertungsscore besitzt daher gegenüber den bestehenden
Diagnosekriterien eine höhere Sensitivität, ohne an
Spezifität zu verlieren (Tabelle 3) [50].
Tabelle
3: Bewertungsscore für Katheter-assoziierte
Infektionen
| Kriterium |
Einstufung |
Punktewert |
Multiplikator |
|
| Fieber-Maximum |
Keines |
0 |
x
0,5
|
| <
38,5 |
1 |
| 38,5
< 39,5 |
2 |
| >=
39,5 |
3 |
|
| Fieberanstieg
(spiking) |
Nein |
0 |
x
0,25
|
| Unbekannt |
1 |
| Ja |
2 |
|
| Schüttelfrost |
Nein |
0 |
x
0,25
|
| Nicht
verwertbar |
1 |
| Ja |
2 |
|
Besserung
nach
Entfernung des Katheters |
Nein,
kein zeitl. Zusammenhang |
0 |
x
3
|
Zeitl.
Zusammenhang in Verbindung
mit einem neuen Antibiotikum |
1 |
| Kein
zeitl. Zusammenhang/keine Antibiotika |
2 |
|
| Blutkultur |
Steril |
0 |
x
2
|
| Keine
durchgeführt |
1 |
| Steril
unter Antibiotika |
2 |
| Positiv |
3 |
|
| Katheter-Eintrittspforte |
Keine
Entzündung |
0 |
x
1
|
| Nicht
beurteilbar |
1 |
| Entzündung |
2 |
|
| Katheter-Kultur |
Steril
ohne Antibiotika |
0 |
|
| Nicht
durchgeführt |
1 |
|
| Steril
unter Antibiotika |
2 |
x
2 |
| Positiv
nach Anreicherung |
3 |
|
Gering
(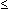 15 Kolonien)
15 Kolonien) |
3 |
|
| Mäßig
(15 - 100 CFU) |
4 |
|
| Reichlich
(> 100 CFU) |
5 |
|
|
Nachweis
eines anderen
Infektionsherdes |
Ja |
0 |
x
3
|
| Nicht
auswertbar |
1 |
| Nein
trotz intensiver Diagnostik |
2 |
|
|
Bewertung:
24 und
< 33: definitiv Katheter-assoziierte Infektion
16 - 24:
wahrscheinlich Katheter-assoziierte Infektion
8 - 16:
möglicherweise Katheter-assoziierte Infektion
< 8:
definitiv nicht Katheter-assoziierte Infektion
Das Ziel
der Untersuchung, die Definition sowie die Verfügbarkeit
der Untersuchungsergebnisse sind bei den verschiedenen Bewertungsschemata
unterschiedlich. Die entscheidende Frage ist, welche Kriterien
für eine Empfehlung bezüglich des Einsatzes antimikrobiell
ausgestatteter Biomaterialien herangezogen werden müssen:
Es ist nahe liegend, die kausalitätsorientierten klinischen
den auf statistischer Inzidenz basierenden theoretischen Kriterien
für eine Empfehlung vorzuziehen.
Morbidität und Letalität
Katheter-assoziierte
Blutstrominfektionen sind mit einer erheblichen Morbidität
und Letalität verbunden. Die Verlängerung des stationären
Aufenthaltes wurde auf einer Erwachsenenintensivstation um 10
Tage, auf einer Neugeborenenintensivstation um 14 Tage beschrieben.
Die Kosten der Behandlung einer Katheter-assoziierten Infektion
wurden von Frank mit 10.000 Euro beurteilt [18]. Pittet erhob
in prospektiven Studien eine zuschreibbare Letalität von
33% und eine Verlängerung des Krankenhausaufenthaltes um
14 Tage [21]. Smith et al. berichteten über eine zuschreibbare
Letalität von 28%, Raad (1999) und Wenzel (2000) von 20%,
Byers 1995 über 19%.
In eigenen
Untersuchungen konnte diese hohe Letalität nicht bestätigt
werden; wir gehen von einer Letalität von < 5% aus,
allerdings bei einer
deutlich höheren Inzidenz. Dabei werden auch Verdachtsfälle
einbezogen, bei denen die gleichen klinischen Konsequenzen,
nämlich Entfernen des Katheters bzw. "Umfädeln"
und Beginn einer Antibiotikatherapie, gezogen werden müssen
[42]. Rello konnte in einer Publikation aus dem Jahr 2000 keinen
einer Katheter-assoziierten Infektion zuzuschreibenden Todesfall
feststellen.
Nach den
in der internationalen Literatur vorgestellten Daten und bei
Zugrundelegung der Fallzahlen aus den USA muss man in Deutschland
pro Jahr mit einer erheblich höheren Rate an ZVK-assoziierten
Infektionen, d.h. mit mindestens 25.000, eher sogar 50.000 -
75.000 septischen
Blutstrominfektionen rechnen. Das bedeutet bei einer Letalität
von 5% mindestens 1.500 und bis zu 3.500 Todesfälle.
|
| Nosokomiale
Pneumonien Nosokomiale
Pneumonien stellen ein besonders häufiges und gravierendes
Problem dar, es liegen jedoch nur wenige kontrollierte Studien
bezüglich der Inzidenz vor. Sie liegen in ihrer Häufigkeit
zwischen 47% (EPIC-Studie) und 28% aller nosokomialen Infektionen
bei traumatologischen Patienten [5]. Die NNIS-Studie berichtet
über einen Prozentsatz von 31% aller nosokomialen Infektionen
[51].
Ein Risikofaktor
liegt in der maschinellen Beatmung; dieses Risiko nimmt mit
einer Rate von 3% pro Beatmungstag in der ersten Woche zu. In
der zweiten und dritten Beatmungswoche reduziert sich dieses
Risiko auf 2 und 1% pro Beatmungstag. Bei einer 3-wöchigen
Beatmung muss man jedoch mit einer Rate zwischen 40 und 60%
rechnen [52].
Ein weiteres
Risiko für eine Beatmungspneumonie liegt in der endotrachealen
Intubation, die die normalen unspezifischen Abwehrmechanismen
wie Husten, die mukoziliäre Clearance und die Zilienfunktion
ausschaltet. Auch die Mikroaspiration von oropharyngealem Sekret,
das mit potenziell pathogenen Mikroorganismen kontaminiert ist,
ist von Bedeutung. Dabei spielen einerseits Antibiotika, die
zu einer Selektion resistenter Mikroorganismen in der Rachenflora
führen, anderseits auch Protonenpumpenhemmer und in geringerem
Maße Sucralfat, die zur Stressulkusprophylaxe verabreicht
werden, eine Rolle. Die fehlende Säureblockade im Magen
ermöglicht es aeroben Mikroorganismen, aus dem Intestinaltrakt
den Magen zu kolonisieren, Keime können bei Regurgitation
in die Luftwege aspiriert werden. Bei nosokomialen Beatmungspeumonien
wird bei sofortiger korrekter Behandlung eine Letalität
von 30%, bei Verzögerung der Behandlung um 48 Stunden oder
Vorliegen eines auf das verabreichte Antibiotikum resistenten
Keims sogar eine Letalität von 80% beschrieben [53]. |
| Nosokomiale
Harnwegsinfektionen Nosokomiale
Harnwegsinfektionen sind für 8 - 35% aller nosokomialen
Infektionen verantwortlich. Das klinische Bild ist meist weniger
schwer
wiegend, die Letalität geringer als bei nosokomialen Infektionen
in anderen Organsystemen. Nosokomiale Harnwegsinfektionen treten
regelhaft bei einem transurethralen Katheter auf, auch wenn
dieser unter streng aseptischen Kautelen gelegt wurde. Das Infektionsrisiko
ist bei einem Zystostomie- oder Nephrostomiekatheter oder einem
Ureterstent geringer, nach 14 Tagen sind jedoch auch diese Katheter
mit großer Wahrscheinlichkeit kontaminiert. Es ist vielfach
auch die Inkrustation der Katheterwand mit Elektrolyten, die
aus einem alkalischen Harn ausfallen, in Kombination mit dem
Schleim aus der Harnröhre, die die Besiedlung mit bakteriellen
Mikroorganismen erleichtert. Mikroorganismen, die bei nosokomialen
Harnwegsinfektionen isoliert werden, sind multiresistente Enterokokken,
E. coli, Enterobacter spp., P. aeruginosa
und C. albicans [54]. Auch durch hohe Wirkstoffkonzentrationen
im Harn ist es schwierig, die Keime von der Oberfläche
zu eliminieren. Als besonderes Problem stellt sich die Tatsache,
dass man bei einer nachfolgenden Operation, z.B. der Korrektur
einer Ureter-Abgangsstenose, in einem kontaminierten Areal operiert.
Anderseits wird postoperativ wiederum ein Fremdkörper als
Platzhalter eingelegt. |
| Weitere
Fremdkörper-assoziierte Infektionen Prinzipiell
ist jeder implantierte Fremdkörper eine potenzielle Quelle
für eine nosokomiale Infektion. Ein besonders gravierendes
Problem stellen Infektionen bei externen Ventrikeldrainagen
dar. Daten aus der Literatur sprechen von 3 -18 Infektionen
des Ventrikelsystems oder Subarachnoidalraums pro 100 externen
Ventrikeldrainagen mit einem Mittelwert von ca. 6%, wobei die
Inzidenz wiederum wesentlich von der Liegedauer abhängt.
Eine prospektive Studie bezüglich der Inzidenz von Liquorrauminfektionen
bei externen Ventrikeldrainagen bei 111 Patienten ergab eine
Rate an nosokomial erworbener Meningitis/Ventrikulitis von 12,8%,
wobei Patienten mit bereits bei Aufnahme bestehender Infektion
im Liquorraum nicht eingeschlossen wurden [55].
Nosokomiale
Liquorrauminfektionen werfen ein besonderes Problem bei der
Behandlung auf. Es handelt sich um Infektionen, die durch multiresistente
Hospitalkeime wie Coagulase-positive und -negative Staphylokokken
inklusive Methicillin-resistenter Staphylokokken, Enterokokken,
aber auch durch multiresistente Gram-negative Enterobacteriaceae
(Enterobacter spp., Klebsiella spp., P.
aeruginosa) oder C. albicans hervorgerufen werden.
Bei der Wahl der entsprechend wirksamen Antibiotika bzw. Antibiotikakombinationen
stellt sich das Problem, dass verschiedene Wirkgruppen wie Aminoglykoside
und Glykopeptide bei intravenöser Verabreichung eine schlechte
Liquorpenetration aufweisen und dadurch keine bakterizid wirksamen
Konzentrationen erreicht werden können. Bei vielen Keimen,
die für aufsteigende
Ventrikelinfektionen verantwortlich sind, ist auch die Blut-Liquor-Schranke
in einem erheblich geringeren Maße gestört als bei
einer Pneumokokken- oder Meningokokken-Meningitis. Daher ist
die Liquorpenetration für ß-Laktam-Antibiotika bei
diesen Patienten stark beeinträchtigt.
Eine nosokomiale
Liquorrauminfektion birgt ein großes therapeutisches Dilemma
und ist bei einem hohen Prozentsatz der betroffenen Patienten
mit Tod oder schwerer geistiger Behinderung verbunden. Außerdem
sind die Kosten für die Behandlung einer nosokomialen Liquorrauminfektion
durch die Notwendigkeit der Aufnahme auf eine Intensivstation,
eine wesentliche Verlängerung des stationären
Aufenthaltes insgesamt und notwendige nachfolgende Rehabilitationsmaßnahmen
exorbitant.
Ähnliche
Probleme treten auch bei Infektionen in Verbindung mit Tenckhoff-Kathetern
zur CAPD auf. Bei diesen Infektionen ist es jedoch leichter,
den Katheter zu entfernen und die Behandlung auf eine kontinuierliche
Hämodialyse umzustellen. Das hat jedoch eine erhebliche
Verschlechterung der Lebensqualität des Patienten und eine
Zunahme des Risikos für Hepatitis B-, C-Infektionen zur
Folge. |
Literatur:
| 1.
Gamer J.S., Jarvis W.R., Emon T.G., Horan T.C., Highes J.M.:
"CDC definitions for nosocomial infections." Am.
J. Infect. Control 16 (1988) 128-140. |
| 2.
Vincent J.L.: "Nosocomial infections in adult intensive-care
units." Lancet 361 (2003) 2068-2077. |
| 3.
Döcke W.D., Randow F., Syrbe H.P.: "Monocyte deactivation
in septic patients: restoration by IFN Gamma treatment."
Nat. Med. 3 (1997) 678-681. |
| 4.
Edmond M.B., Wallace S.E., McClish, Pfaller M.A., Jones
R.N., Wenzel R.P.: "Nosocomial bloodstream infections
in the United States hospitals. A three year analysis."
Clin. Infect. Dis. 29 (1999) 239-244. |
| 5.
Vincent J.L., Bihari D., Suter P.M.: " The prevalence
of nosocomial infection in intensive care units in Europe:
the result of the EPIC study." JAMA 274 (1995) 639-644. |
| 6.
Decker M.D., Edwards K.M.: "Central venous catheter
infections." Ped. Clin. North Am. 35 (1988) 579-612. |
| 7.
Wang J.T., Chang S.C., Ko W.J.: "A hospital acquired
outbreak of methicillin-resistant Staphylococcus aureus
infection initiated by a surgeon carrier." J. Hosp.
Infection 47 (2001) 104-109. |
| 8.
Kastner U., Glasl S., Lugauer S., Guggenbichler J.P.: "Sepsis
-Neue Erkenntnisse zur Pathogenese, Therapie und Prävention."
Antibiotika Monitor XVII/4 (2001) 66-80. |
| 9.
KropecA., SchulgenG.,JustH., Geiger K., Schumacher M., Daschner
F.: "Scoring system for nosocomial pneumonia in ICUs."
Intensive Care Med. 22 (1996) 1155-1161. |
| 10.
Mermel L.A.: "New technologies to prevent intravascular
catheter related bloodstream infections." Emerging
Infectious Diseases 7 (2001) 197-199. |
| 11.
Sitges-Serra A., Linares J., Garau J.: "Catheter sepsis;
the clue is the hub." Surgery 97 (1985) 355-357. |
| 12.
Centers of Disease Control: "Postsurgical infections
associated with an extrinsically contaminated intravenous
anesthetic agent. California, Illinois, Maine and Michigan."
Morbid. Mortality weekly report. 39 (1990) 426-433. |
| 13.
Collignon P.J.: "Intravascular catheter related sepsis.
A common problem." Med. J. Aust. 161 (1994) 374-378. |
| 14.
Mayor S.: "Hospital acquired infections kill 5,000
patients a year in England." BMJ 321 (2000) 1370. |
| 15.
Ärztezeitung, Febr. 2004, Seite 9. |
16.
"Prävention Gefäßkatheter-assoziierter
Infektionen: Empfehlungen der Kommission für Krankenhaushygiene
und Infektionsprävention beim Robert-Koch-Institut
(RKI)
BundesgesundheitsbI.-Gesundheitsforsch.-Gesundheitsschutz."
45: II (2002) 907-924. |
| 17.
"National Nosocomial Infections Surveillance (NNIS)
Report, data summary from January 1992 to June 2002 issued
August 2002." Am. J. Infect. Contr. 30 (2002) 458-475. |
18.
Frank U., Chojnacki T., Dettenkofer M., Daschner F.: "Cost-effectiveness
of an antiseptic-impregnated
central venous catheter in the ICU." Correspondence:
Int. Care
Med. 2002. |
19.
Digiovine B., Chenoweth C., Watts C., Higgins M.: "The
attributable mortality and costs of primary bloodstream
infections in the intensive care unit." Am. J. Resp.
and
Crit. Care Med. 160 (1999) 976-981. |
20.
Byers K., Adal K., Anglim A.: "Case fatality rate for
catheter related bloodstream infections (CRSBI): a metaanalysis."
In Proceedings of the 5th annual meeting of the
Society for Hospital Epidemiology of America (1995). |
| 21.
Pittet D., Wenzel R.P.: "Nosocomial bloodstream infections.
Secular trends in rates, mortality and contribution to total
hospital deaths." Arch. Intern. Med. 155 (1995) 1177-1184. |
| 22.
Stover B.H., Shulman S. T., Bratcher D.F., Brady M. T.,
Levine G.L., Jarvis W.R.: "Nosocomial infection rates
in US childrens hospitals neonatal and intensive care units."
Am. J. Infect. Contr. 29 (2001) 152-157. |
| 23.
Gastmeier P., Weist K., Rüden H.: "Catheter-associated
primary bloodstream infections: Epidemiology and preventive
methods." Infection 27 Suppl. 1 (1999) 1-6. |
| 24.
Richards M.J., Edwards J.R., Culver D.H., Gaynes R.P.: "Nosocomial
infections in pediatric intensive care units in the United
States." Pediatrics 103 (1999) 39-45. |
| 25.
Raymond J., Aujard Y. and the European Study Group Nosocomial
Infections in Pediatric Patients: "A European, multicentric
prospective study." Infect. Contr. Hosp. Epidemiol.21
(2000) 260-263. |
| 26.
Jarvis W.: "Epidemiology of nosocomial infections in
pediatric patients." Ped. Inf. Dis. J. 6: 344-351 (1987)
Infection Control and Hosp. Epidemiol. 21 (4) (2000) 260-263. |
| 27.
Chien L. Y., Macnab Y., Aziz K., Andrews W., McMillan D.D.,
Lee S.K.: "Variations in central venous catheter related
infection risks among Canadian neonatal intensive care units."
Ped. Inf. Dis. J. 21 (6) (2002) 505-511. |
| 28.
Urrea M., Pons M., Serra M., Latorpe C., Palomeque A.: "Prospective
incidence study of nosocomial infections in a pediatric
intensive care unit." Ped. Inf. Dis. 22 (2003) 490-493. |
| 29.
Wallace W.C., Cinat M., Gornick W:B., Lekawa M.E., Wilson
S.E.: "Nosocomial infections in the surgical intensive
care unit: a difference between trauma patients and surgical
patients." Am. Surg. 65 (1999) 987-990. |
| 30.
Markowicz P., WolffM., Dejani K.: "Multicenter prospective
study of ventilator associated pneumonia during acute respiratory
distress syndrome: incidence prognosis and risk factors."
Am. J. Resp. and Crit. Care Med. 161 (1999) 1942-1948. |
| 31.
Milliken J., Tait G., Ford Jones L., Mindorf C., Gold R.,
Mullins G.: "Nosocomial infections in a pediatricd
intensive care unit." Crit. Care Med. 16 (3) (1988)
233-237. |
| 32.
Karthaus M., Doellmann T., Klimasch T., Krautner J., Heil
G., Ganser A.: "Central venous catheter infections
in patients with leucemia." Chemotherapy 48 (2002)
154-157. |
| 33.
Souweine B., Traore 0., Aublet-Cuvelier B.: "Dialysis
and central venous catheter infections in critically ill
patients: results of a prospective study." Crit. Care
Med. 27 (1999) 2394-2398. |
| 34.
Koolen D.A., van Laarhoven H. W., Wobbes T., Punt C.J.:
"Single centre experience with tunnelled central venous
catheters in 150 cancer patients." Neth. J. Med. 60
(10) (2002) 397-401. |
| 35.
Guggenbichler J.P., Carbon R., Lugauer S., Geitner U., Regenfus
A., Böswald M., Greil J., Bechert Th., Hümmer
P.: "Reduced incidence of catheter related infections
in long term i. v. catheters in children by use of a silver
impregnated catheter." ECCMID Stockholm (2000). |
| 36.
Sirnon A.: Jahrestagung Inf. Päd. Onkologie, Düsseldorf,
Nov. (2003). |
| 37.
Wildhaber B., Kistler W., Catfish u.: "Erfahrungen
mit dem Port-a-Cath.-System bei Kindern." Schweizer
Med. Wochenschr. 130 (2000) 732-738. |
| 38.
Hartkamp A., van Boxtel A.J.H., Zonnenberg B.A., Witteveen
P.O.: "Totally implantable venous access devices: evaluation
of complications, and a prospective comparative study of
two port systems." The Netherland J. Med. 57 (2000)
215-223. |
| 39.
Cornely O.A., Bethe U., Pauls R., Waldschmidt D. T.H. :
"Phlebitisinzidenz peripherer Teflon-Venenverweilkatheter."
Hyg. Med. 27 (2002) 400-404. |
| 40.
Fridkin S.K., Pear S.M., Williamson T.H., Galgiani J.N.,
Jarvis W.R.: "The role of understaffing in central
venous catheter associated bloodstream infections."
Infect Control Hosp. Epidemiol. 17 (1996) 150-158. |
| 41.
Gaukroger P.B., Roberts J.G., Manners T.A.: "Infusion
Thrombophlebitis: a prospective comparison of 645 Viaion
and Teflon cannulae in anaesthetic and postoperative use."
Anaesth Intensive Care 16 (1988) 265 -271. |
| 42.
Sherertz R.J., Ely E. W., Westbrook D.M.: "Education
of physician in training can decrease the risk ofvascular
catheter infection." Ann. Int. Med. 132 (2000) 641-648. |
| 43.
Safdar N., Maki D.: "Inflammation at the insertion
site is not predictive of a catheter related bloodstream
infection with short term, noncuffed central venous catheters."
Crit. Care Med. 30 (2002) 2632-2635. |
| 44.
Donnelli G., Francolini I.: "Efficacy of antiadhesive,
antibiotic and antiseptic coatings in preventing catheter
related infections, a review." J. Chemoth. 13(6) (2001)
595-606. |
| 45.
Hiramatsu J., Nasu M.: "Intravascular device-related
infections." Nippon Rinsho. 60 (11) (2002)2107-2111. |
| 46.
Douard M.C., Leverger G., Paulien R., Waintrop C., Clementi
E., Eurin B., Schaison G.: "Quantitative blood cultures
for diagnosis and management of catheter related sepsis
in pediatric hematology and oncology patients." Intensive
care Med. 17 (1991) 30-35. |
| 47.
Lyte M., Freestone P.P., Neal C.P., 0lson B.A., Haigh Er.,
Baystone R., Williams R.H.: "Stimulation of Staphylococcus
epidermidis growth and biofilm formation by catecholamine
inotropes." Lancet 361 (2003) 130-135. |
| 48.
Veenstra D.L., Saint S., Saha S., Lumley Th., Sullivan S.D.:
"Efficacy of antiseptic - impregnated central venous
catheters in preventing catheter-related bloodstream infection."
JAMA 281 (1999) 261-267. |
| 49.
Guggenbichler J.P., Beer A., Böswald M., Braun G.G.,
Burgmann H., Lugauer S., Regefus A., Baratto F., Carlon
R., Meggiolaro M., Stoiser B., Frass M., Giron G.P.: "Reduced
rates of catheter related bloodstream infections by use
of a silver impregnated central venous catheter: results
of an European multicenter study." ECCMID Stockholm
(2000). |
| 50.
Lugauer S., Regenfus A., Böswald M., Martus P., Gais
C., Bechert T., Greil J., Guggenbichler J.P.: "A new
scoring system for the clinical diagnosis of catheter related
infections." Infection 27, Suppl. I ( 1999) 49-53.
|
| 51.
Richards M.J., Edwards J.R., Culver D.H., Gaynes R.P:. "Nosocomial
infections in combined medical surgical intensive care units
in the United States." Infect. Contr. Hosp. Epidemiol.
21 (2000) 510-515. |
| 52.
Cook D.J., Walter S.D., Cook R.J.: "Incidence of and
risk factors for ventilator-associated pneumonia in critically
ill patients." Ann. Intern. Med. 129 (1998) 433-440. |
| 53.
Langer M., Mosconi P., Cigada M., Mandelli M.: "Long
term respiratory support and ! risk of pneumonia in critically
ill patients." Am. Rev. Resp. Dis. 140 (1989) 302-305. |
| 54.
Appelgren P., Hellstrom I., Weitzberg E., Soderlund v:,
Bindslev L., Ransjo U.: "Risk factors for nosocomial
intensive care infections: a long term prospective analysis."
Acta Anaesthesiol. Scand. 45 (2001) 710-719. |
| 55.
Popp W., Müller 0., Schoch B., Hansen D., Müller
D., Stolke D.: "Infektionsraten bei externen Ventrikeldrainagen."
Hyg. Med. Suppl. 1 (2004) 43. |
Anschrift
des Verfassers:
Univ.-Prof. Dr. J. Peter Guggenbichler
Klinik mit Poliklinik der Universität Erlangen-Nürnberg
D-91054 Erlangen, Loschgestraße 15
E-Mail: prof.guggenbichler@gmx.de
|
|
|