| Toxoplasmose |
| R. Gratzl, A. Pollak Universitätsklinik für Kinder- und Jugendheilkunde, Abteilung für Neonatologie, Intensivmedizin und angeborene Störungen, Wien (Vorstand: Univ.-Prof. Dr. A. Pollak) |
| Schlüsselwörter:
Toxoplasmose |
Zusammenfassung Eine Infektion mit Toxoplasma gondii verläuft postnatal beim immunkompetenten Wirtsorganismus in 90% der Fälle asymptomatisch. Eine Lymphadenopathie ist die häufigste klinische Manifestation. Die Infektion erfolgt meist oral durch den Genuß ungenügend gegarten Fleisches oder durch die Aufnahme von durch Katzenkot ausgeschiedenen Oocysten in rohen Nahrungsmitteln. Der Parasit kapselt sich ab und verbleibt lebenslang als latente Infektion im Wirtsorganismus. Bei Immunsuppresion (z.B. AIDS) oder bei unreifem Immunsystem im Falle einer fetalen Infektion werden schwere Verlaufsformen, typischerweise mit ZNS-Symptomatik, beobachtet. Erfolgt also während der Schwangerschaft eine mütterliche Erstinfektion, so kommt es im Rahmen der Parasitämie zu einer fetalen Infektion mit den typischen Symptomen Hydrocephalus, intracranielle Verkalkungen und Retinochoroiditis. Erfolgt die fetale Infektion erst gegen Ende der Schwangerschaft, erscheint das Neugeborene klinisch gesund. Es entwickeln sich aber bei Nichtbehandlung in 80-90% der Fälle Spätsymptome, meist als Retinochoroiditis. Durch geeignete Information der Schwangeren einerseits, sowie durch serologisches Screening im Rahmen der Mutter-Kind-Paß-Untersuchung und dadurch frühzeitige Erkennung und Behandlung einer mütterlichen Erstinfektion können fetale Infektionen vermieden werden. Eine zusätzliche Hilfe stellt der direkte Erregernachweis mittels Polymerase-Kettenreaktion (PCR) aus dem Fruchtwasser dar. Durch optimale Therapie während der Schwangerschaft, und im Falle einer connatalen Toxoplasmose Behandlung des Kindes während des ersten Lebensjahres, können weitere Schädigungen und obengenannte Spätsymptome verhindert werden. |
Key-words: Toxoplasmosis |
Abstract In the immunological normal person an infection with Toxoplasma gondii after birth may be asymptomatic in 90% of cases, most frequently it causes lymphadenopathy. Toxoplasma gondii usually is acquired from eating food, that contains cysts or is contaminated with oocysts, which are released by acutely infected cats by the feces. Once acquired, the latent encysted organism persists for the lifetime in the host. In the immunocompromised patient (e.g. AIDS) acute infection most often causes symptomes related to the central nervous system. Transmission to the fetus occurs when the infection is acquired by an immunological normal mother during gestation. Congenital toxoplasmosis, if untreated, almost always causes symptoms in the perinatal period or later in life. The most frequent signs are retinochoroiditis, hydrocephalus, intracerebral calcifications. If the fetal infection occurs late in pregnancy, the newborn appears healthy at birth, but has symptoms such as retinochoroiditis by adolescence, if not treated. Both, counseling women about methods avoiding transmission of toxoplasma gondii during pregnancy, and in consequence of serological screening early identification of primary infected pregnant women and subsequent treatment during gestation, prevent fetal transmission. Direct detection of the parasite DNA in ammotic fluid by means of polymerase-chain-reaction (PCR) may be an additional diagnostic tool for the decision of optimal treatment. Treatment during pregnancy and in case of congenital toxoplasmosis treatment of the infected infant until the end of the first year of life reduces sequelae and prevents symptoms later in life. |
Einleitung
|
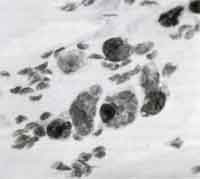
| Ätiologie und Epidemiologie Toxoplasma gondii, ein Protozoon aus der Ordnung Coccidia, kann sich nur in lebenden Zellen vermehren (Abb. 1). Gewebezysten enthalten Tausende Parasiten und finden sich hauptsächlich in ZNS, Skelett und Herzmuskulatur des Wirtsorganismus. Toxoplasma gondii kann sich in allen Geweben von Säugetieren und Vögeln vermehren, die Infektion verläuft in sämtlichen Wirtsorganismen mit ähnlichen Symptomen.
|
| Pathogenese
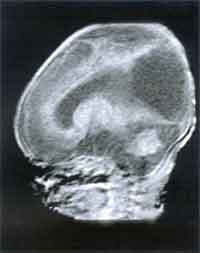
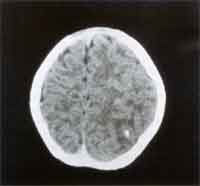
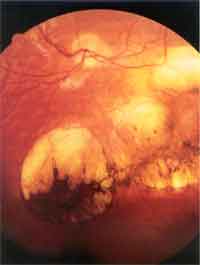
und Klinik Die Inkubationszeit ist variabel (4 - 21 Tage) und hängt von der Virulenz des Stammes, der Infektionsdosis, dem Entwicklungsstadium des Parasiten, der Immunantwort und von zum Teil noch unbekannten prädisponierenden Faktoren des Wirtsorganismus ab. Bei peroraler Infektion vermehrt sich der Parasit zunächst in den Epithelzellen des Gastrointestinaltraktes.Die Zellen rupturieren, es kommt zur Aussaat über Lymphwege und Blut in den ganzen Körper und in der Folge zu lokalen nekrotischen Entzündungsherden, die mit der Entwicklung der Immunantwort verschwinden. Es bilden sich Gewebszysten, die schon 7 Tage nach Infektion nachweisbar sind und lebenslang bestehen bleiben. Diese sind für ein Wiederaufflackern einer akuten Erkrankung im Falle einer Immundefizienz oder für das Entstehen einer Retinochoroiditis als Spätfolge einer connatalen Toxoplasmose verantwortlich. Die Infektion verläuft bei kompetentem Immunsystem meist asymptomatisch. Das häufigste klinische Symptom ist die Schwellung eines oder mehrerer meist zervikaler Lymphknoten, die mehrere Monate bestehen und schmerzhaft sein kann. Meist ist dies mit anderen untypischen Zeichen wie Fieber, Krankheitsgefühl, Athralgien, Myalgien vergesellschaftet. Bei präpartaler Infektion treffen die Erreger auf ein noch nicht ausgereiftes Immunsystem. Es können sich daher Zysten in allen Geweben, vor allem aber in Gehirn und Retina ausbilden. Bei Erstinfektion der Mutter während der Schwangerschaft erfolgt die Transmission des Erregers auf den Fetus hämatogen, wobei die Bildung eines placentaren Infektionsherdes Voraussetzung ist. Unbehandelte mütterliche Infektionen führen im 1. Trimenon nur in ca 17% zu einer fetalen Infektion, die jedoch sehr schwer verläuft. Im 3. Trimenon ist das fetale Erkrankungsrisiko ca. 65%, jedoch mit mildem oder subklinischem Verlauf [6]. Durch die Wehentätigkeit kann die Plazentaschranke unterbrochen werden, sodaß das Neugeborene auch sub partu infiziert werden kann. Das Spektrum der klinischen Zeichen reicht von milden Symptomen wie periphere Narben der Retina, Frühgeburtlichkeit, niedriges Geburtsgewicht, Ikterus prolongatus bis hin zu schweren Verlaufformen wie Hydrocephalus, Encephalitis, intracranielle Verkalkungen, Retinochoroiditis, Microcephalus, psychomotorische Retardierung, Krampfanfälle, Hydrops fetalis und intrauteriner Fruchttod. In nur 10% der Fälle ist mit einer schweren Erkrankung zu rechnen. 90% sind subklinische Infektionen, die aber für die überwiegendene Mehrheit der Augentoxoplasmose des Kindes- und Jugendalters verantwortlich sind. Zusätzlich könnnen sich auch neurologische Komplikationen entwickeln [1, 2, 3, 4, 5]. Bei Immunsuppression wie AIDS, nach Organtransplantation, Therapie mit Corticosteroiden kann eine akute oder reaktivierte latente Toxoplasmoseinfektion disseminiert verlaufen. Patienten mit AIDS haben ein sehr hohes Risiko, an einer Encephalitis zu erkranken, die unbehandelt fulminant verläuft. Die Retinaläsionen bei AIDS-Patienten zeigen sehr große Nekroseareale, die massenhaft Erreger beinhalten [6]. |
| Diagnose Serologie Eine akut erworbene Toxoplasmainfektion beim immunkompetenten Individuum wird durch die Seroconversion von primär negativem zu positivem Antikörpertiter und gleichzeitig positivem IgM diagnostiziert [5]. IgG-Antikörper gegen Toxoplasma gondii, die mit dem Sabin-Feldman-Test bestimmt werden können, lassen sich schon 1 - 2 Wochen nach Aufnahme des Erregers nachweisen. Es erfolgt ein kontinuierlicher Titeranstieg, um 6 - 8 Wochen nach Infektion den Höchsttiter zu erreichen. Der Titeranstiegswinkel verläuft bei nahezu allen akuten Infektionen ident und erlaubt in den meisten Fällen auch ohne Vorliegen eines negativen Ersttests, den Zeitpunkt der stattgehabten Infektion einzugrenzen. Der folgende Titerabfall erfolgt über Monate und Jahre und persistiert schließlich im mittleren oder niedrigen Bereich lebenslang. Die Höhe des Antikörpertiters korrelliert nicht mit der Schwere der Erkrankung [5]. IgM-Antikörper können schon 5 Tage nach Infektion nachweisbar sein, steigen schnell an und verschwinden schließlich nach Wochen oder Monaten. In seltenen Fällen können sie auch über Jahre persistieren. Der Nachweis von IgM im Nabelschnurblut ist für eine congenitale Infektion beweisend, eine IgM-Negativität schließt diese jedoch keineswegs aus, da je nach angewandter Testmethode bis zu 75% der infizierten Neugeborenen IgM-negativ sind. Um testbedingt falsch niedrige IgM-Resultate möglichst gering zu halten, sollten nur hochsensible Testmethoden wie der IgM-Immunosorbent Agglutination Assay (ISAGA-IgM-Test) angewendet werden und auch grenzwertig positive IgM-Testergebnisse als positiv gewertet werden. IgM-Positivität beim Kind mit congenitaler Toxoplasmainfektion hält nur sehr kurze Zeit an. Da maternale IgG-Antikörper im Gegensatz zu IgM die Plazentaschranke frei passieren können, entspricht der beim Neugeborenen erhobene Titer dem mütterlichen, oft liegt er auch eine Titerstufe höher. Diese IgG-Antikörper werden vom kindlichen Organismus in vorhersehbarer Weise innerhalb des ersten Lebensjahres abgebaut. Die Halbwertszeit beträgt ca. 30 Tage. Der Nachweis persistierender oder steigender IgG-Titer zu einem Zeitpunkt, zu dem die mütterlichen diaplazentar übertragenen Antikörper im Abfall begriffen sind, weist auf die Produktion von kindlichen Antikörpern nach fetaler Antigenexposition und somit auf eine connatale Infektion hin. Die Beobachtung der IgG-Titerverlaufskurve im ersten Lebensjahr ist beim Fehlen nachweisbarer IgM-Antikörper die einzige verläßliche serologische Methode, eine congenitale Infektion zu beweisen oder auszuschließen [5]. Bei immunsupprimierten Patienten können die IgG-Titer niedrig sein, die IgM-Antikörper auch fehlen. In diesen Fällen ist der direkte Nachweis des Erregers bzw. seiner DNA aus Blut oder Liquor hilfreich.
Direkter Erregernachweis Der Erreger kann in Tier- oder Gewebekultur aus Blut, Liquor und anderen Körperflüssigkeiten, aber auch aus verschiedensten Gewebeproben angezüchtet und nachgewiesen werden. Dies dauert jedoch einige Wochen und setzt eine sofortige Verarbeitung der Proben voraus, da die Viabilität des Erregers gewährleistet sein muß. Seit einigen Jahren ist es möglich, mittels Polymerase-Kettenreaktion (PCR) die DNA des Erregers auch in geringsten Mengen aus verschiedensten Körperflüssigkeiten zu vermehren und nachzuweisen. Dies ist vor allem für die Diagnose einer connatalen Toxoplasmainfektion hilfreich und kann ab der 15. SSW eingesetzt werden [7, 8, 9, 10]. Wenn durch die Serologie eine mütterliche Infektion gesichert oder sehr wahrscheinlich ist, kann durch die PCR aus Amnionflüssigkeit eine fetale Infektion bewiesen oder ausgeschlossen werden. Diese direkte pränatale Diagnostik ermöglicht eine differenzierte medikamentöse Behandlung und eine objektive Basis für die Beratung der Schwangeren. |
| Prävention Insbesondere seronegative Mütter sollten am Beginn der Schwangerschaft genau informiert werden, wie eine Infektion mit Toxoplasma gondii vermieden werden kann: Es sollte kein rohes Fleisch gegessen werden. Es sollten nach der Zubereitung von rohem Fleisch die Hände gut gereinigt werden. Ebenso sollten Gemüse und Früchte gut gewaschen werden. Jeglicher direkter Kontakt mit Katzenkot sollte vermieden werden. Daher ist auch Vorsicht bei Gartenarbeit oder Spielen mit Kindern in einer Sandkiste geboten. Katzen sollten im Haus gehalten werden, also keinen Kontakt zu Oocysten-hältigem Katzenkot haben und nicht mit rohem Fleisch gefüttert werden. Während der Schwangerschaft sollten die im Rahmen der Mutter-Kind-Paß-Untersuchung vorgesehenen serologischen Kontrollen und Ultraschalluntersuchungen durchgeführt werden. In Österreich sind bei ca. 30% der Schwangeren Antikörper gegen Toxoplasma gondii nachweisbar. In ca. 70% besteht also das Risiko einer congenitalen Toxoplasmainfektion bei Erstinfektion der Mutter während der Schwangerschaft. Bei Seronegativität am Beginn der Schwangerschaft ist ein Folgetest im 2. und 3. Trimenon vorgesehen [11]. Eine eventuell stattgehabte Infektion kann so frühzeitig erkannt und behandelt werden [11, 12]. |
| Therapie Pyrimethamin und Sulfadiazin wirken synergistisch gegen Toxoplasma gondii und werden bei verschiedensten Formen der Toxoplasmainfektion verwendet. Diese Kombinationstherapie ist placentagängig und wird während der Schwangerschaft wegen möglicher Teratogenität ab der 16. SSW verabreicht. Ebenso wird sie auch zur Therapie der congenitalen Toxoplasmose während des ersten Lebensjahres verwendet. Pyrimethamin als Folsäureantagonist kann als Nebenwirkung eine reversible dosisabhängige Knochenmarksdepression verursachen [6]. Um dies zu verhindern, wird während der Behandlung zusätzlich Folinsäure (Leucovorin) verabreicht und es werden regelmäßig Blutbildkontrollen durchgeführt. Spiramycin wird vor der 16. SSW verabreicht, danach abwechselnd mit obengenannter Kombinationstherapie bis zur Geburt des Kindes. Spiramycin verhindert die Transmission des Erregers auf den Fetus, kann daher bei negativem Erregernachweis mittels PCR bis zur Geburt des Kindes als Monotherapie verwendet werden [13, 14]. Spiramycin ist jedoch bei schon erfolgter fetaler Infektion nicht ausreichend, da es ist nur in geringem Ausmaß placentagängig ist [6, 15]. In diesem Fall ist die obengenannte Kombinationstherapie bis zur Geburt notwendig. Im Falle einer serologisch gesicherten mütterlichen Erstinfektion während der Schwangerschaft und nachfolgender Therapie muß im Einzelfall entschieden werden, ob das Neugeborene, gerade auch wenn es bei der Geburt als gesund imponiert, während des ersten Lebensjahres behandelt werden soll. Wenn der direkte Erregernachweis aus Amnionflüssigkeit mittels PCR negativ ist, Spiramycin bis zur Geburt verabreicht wurde, eine connatale Toxoplasmose-Infektion also unwahrscheinlich gilt, sollte das Kind trotzdem nachuntersucht und der Titerverlauf bis zur Negativität beobachtet werden [14]. Die Therapie des Neugeborenen und des Kindes im ersten Lebensjahr erfolgt ebenfalls mit Pyrimethamin (1 mg/kg/d), Sulfadiazin (75 mg/kg/d), Folinsäure abwechseld mit Spiramycin (100 mg/kg/d) durch das gesamte erste Lebensjahr [6, 14]. Durch die rechtzeitige Diagnose und Behandlung während der Schwangerschaft kann eine Infektion bzw. eine Schädigung des Fetus verhindert werden. Ebenso kann durch die konsequente Behandlung eines infizierten Kindes während des ersten Lebensjahres die Prognose vorhandener klinischer Symptome deutlich gebessert bzw. im Falle einer subklinischen Infektion die Spätfolgen im Kindes- und Adoleszentenalter verhindert werden. |
| Literatur: 1. Koppe J.G., Loewer-Sieger D.M., de-Roever-Bonnet H.: "Results of 20-years follow-up of congenital toxoplasmosis." Lancet 1 (8475) (1986) 254-6. 2. Wilson C.B., Remington J.S., Stagno S., Reynolds D.W: "Development of adverse sequelae in children born with subclinical Toxoplasma infection." Pediatrics 66 (5) (1980) 767-74. 3. McAuley J., Boyer K.M., Patel D., Mets M., Swisher C., Roizen N. et at.: "Early and longitudinal evaluations of treated infants and children and untreated historical patients with congenital toxoplasmosis: The Chicago Collaborative Treatment trial." Clin. Infect. Dis. 18 (1) (1994) 38-72. 4. Roizen N., Swisher C.N., Stein M.A., Hopkins J., Boyer K.M., Holfels E. et al.: "Neurologic and developmental outcome in treated congenital toxoplasmosis." Pediatrics 95 (1) (1995) 1120. 5. Remington J.S., Desmonts G.: "Toxoplasmosis." In: Remington J.S., Klein J.O. editors, Infectious diseases of the fetus and the newborn infant, Philadelphia: W B.Saunders (1990) 89-195. 6. Ho-Yen D., Joss A.: "Human toxoplasmosis." New York: Oxford University Press (1992). 7. Daffos F., Forestier F, Capella-Pavlovsky M., Thulliez P, Aufrant C., Valenti D., Cox W: "Prenatal Menagement of 746 pregnancies at risk for congenital toxoplasmosis." New England Journal of Medicine 318 (1988) 271-275 B. Burg J.L., Grover C.M., Pouletty P, Boothroyd J.C.:"Direct and sensitive detection of a pathogenic protozoan, Toxoplasma gondii, by polymerase chain reaction." J. Clin. Microbiol. 27 (8) (1989) 1787-92. 9. Grover C.M., Thulliez E, Remington J.S., Boothroyd J.C.: "Rapid prenatal diagnosis of congenital Toxoplasma infection by using polymerase chain reaction and amniotic fluid." J. Clin. Microbiol. 28 (l0) (1990) 2297-301. 10. Hohlfeld P, Daffos F., Costa J.M., Thulliez P., Forestier E, Vidaud M.: "Prenatal diagnosis of congenital toxoplasmosis with a polymerasechain-reaction test an amniotic fluid." N. Engl. J. Med. 331 (11) (1994) 695-9. 11. Aspöck H., Pollak A.: "Prevention of prenatal toxoplasmosis by serological screening of pregnant women in Austria." Scand. J. Infect. Dis. Suppl. 84 (1992) 32-37 12. Aspöck H., Husslein P, Janisch H., Möse J., Pollak A., Vander-Möse A., Winter R.: "Toxoplasmose. Empfehlungen zur Behandlung der Toxoplasma Erstinfektion in der Schwangerschaft und der konnatalen Toxoplasmose." Gynäkol. Geburtshilfliche Rundsch. 34 (1994) 50-51. 13. Knerer B., Hayde M., Gratzl R., Bernaschek G., Strobl W, Pollak A.: "Direkter Nachweis von Toxoplasma gondii mit Polymerase Kettenreaktion zur Diagnostik einer fetalen Toxoplasma Infektion." Wien. Klin. Wochenschr. 107(4) (1995) 137-140. 14. Gratzl R., Hayde M., Kohlhauser C., Hermon M., Burda G., Strobl W., Pollak A.: "Follow-up of Infants with Congenital Toxoplasmosis detected by Polymerase Cain Reaction Analysis in Amniotic Fluid." European Journal of Clinical Microbiology and Infectious Diseases 17 (1998) 853-858. 15. Couvreur J., Desmonts G., Thulliez P : "Prophylaxis of congenital toxoplasmosis. Effects of spiramycin an placental infection." J. Antimicrob. Chemother. 22 suppl. B (1988) 193-200. |
| Anschrift des Verfassers: Dr. Regina Gratzl Univ.-Klinik für Kinder- und Jugendheilkunde, Abt. für Neonatologie, Intensivmedizin und angeborene Störungen A-1090 Wien, Währinger Gürtel 18-20 |