| Epidemiologie, Klinik und mikrobiologische Diagnostik der Pest |
|
J. Heesemann, A. Rakin |
| Schlüsselwörter:
Rattenfloh, Beulenpest, Pestherde, Wayson-Färbung, Virulenzplasmid, Multiresistenz |
Zusammenfassung Die Pest gehört nicht zu den „ausgestorbenen“ Seuchen. In den Ländern Tansania, Zaire, Vietnam, Peru, Birma (Myanmar) und Madagaskar erreicht sie beachtenswerte Infektionshäufigkeiten. Nach dem 11. September 2001 wurde der Pesterreger als potentielle bioterroristische Waffe erneut in der Öffentlichkeit diskutiert. Das Jahr 2001 hat durch die Veröffentlichung der Genomsequenz von Yersinia pestis auch einen großen Erkenntnisgewinn für die Pestforschung erbracht. Es gibt drei typische Krankheitsbilder der Pest: Beulenpest, Pestsepsis und Pestpneumonie. Die schnelle Diagnose und eine adäquate Antibiotikatherapie sind lebensrettend. Das therapeutische Mittel der ersten Wahl ist Streptomycin. Prophylaktisch können Tetracycline oder Trimethoprim-Sulfamethoxazol gegeben werden. Eine Antibiotikatestung ist dringend erforderlich, seitdem in Madagaskar multiresistente Pesterreger isoliert wurden. |
Key-words: Rat flea, bubonic plague, plague foci, Wayson-stain, virulence plasmid, multidrug resistance |
Summary Plague has not disappeared. It still belongs to a dangerous infectious disease in Tanzania, Zaire, Vietnam, Peru, Birma (Myanmar) and Madagascar. After September 11th, 2001 the causative agent of plague was again discussed as a potential bioterroristic weapon. In 2001 the total genome sequence of Yersinia pestis has been published and thus will stimulate Y. pestis research. The principle forms of plague are bubonic, septicemic and pneumonic. A rapid diagnosis and initiation of suitable antibiotic treatment are required to reduce lethality of this disease. Streptomycin is the drug of the first choice. Tetracycline and trimethoprim-sulfamethoxazole are recommended for prophylaxis. In vitro testing of antibiotic resistance of Y. pestis is required since multidrug resistant strains have been reported in 1997. |
| Einleitung
Die Pest gehört zu den gefürchtetsten
Infektionskrankheiten, die wir kennen [1]. Die Geschichte belegt
wenigstens drei Pandemien, denen mehr als 100 Millionen Menschen
zum Opfer fielen (Justinianische Pest: 6. Jahrhundert n. Chr., „Schwarzer
Tod“: Mitte des 14. Jahrhunderts, Hongkong-Pest: Ende des 19.
Jahrhunderts). Der Erreger, Yersinia pestis, wurde von Alexandre
Yersin 1894 in Hongkong entdeckt. Einige Jahre später zeigten
Ogata und Simond, dass der Pesterreger durch Rattenflöhe übertragen
wird. Die Hongkong-Pest führte zu einer weltweiten Verbreitung
des Pesterregers – erstmalig gelangte der Pesterreger an die
Westküste Amerikas und nach Australien. Die Pest hat heute
ihren Schrecken verloren. In Westeuropa gibt es keine Pestherde.
Eine rechtzeitig erkannte Pesterkrankung kann mit Antibiotika effektiv
therapiert werden. Dieser Zustand sollte uns aber nicht glauben
lassen, dass die Pest besiegt sei. |
| Mikrobiologie
des Pesterregers
Seit 1964 wird der Pesterreger als
Yersinia pestis bezeichnet (früher Pasteurella pestis).
Zum Genus Yersinia gehören inzwischen 11 Arten, wobei
neben Y. pestis noch Y. pseudotuberculosis und Y.
enterocolitica von humanmedizinischer Bedeutung sind [1].
Zur Absicherung der Identifizierung
von Y. pestis kann das in Tabelle 1 dargestellte biochemische
Differenzierungsschema dienen. Die signifikantesten Merkmale sind
das Fehlen der Motilität und der Hydrolyse von Harnstoff [1].
Von epidemiologischem Interesse ist die Biotypisierung (eine Serotypisierung
ist aufgrund des kurzkettigen O-Antigens nicht möglich). Man
unterscheidet die Biotypen antiqua, mediaevalis und orientalis (Tab.
2). Zu ähnlichen Ergebnissen führen auch genomische Restriktionsmuster
von Y. pestis [5].
Y. pestis wird schnell abgetötet durch Erwärmen auf 56° C für 15 min und durch Sonnenlichtexposition (3-4 h). In getrockneten Sekreten oder Blut und im Flohfäzes ist der Erreger über 3 Wochen lebensfähig. In Erdhöhlen von Nagetieren und im Rattenfloh kann Y. pestis über ein Jahr überleben. Da frische Y. pestis-Isolate in der Regel hoch virulent sind, dürfen die Erreger oder Pest-verdächtige Proben nur in einem L3-Sicherheitslabor bearbeitet werden. |
| Molekularbiologie
der Pathogenität von Y. pestis
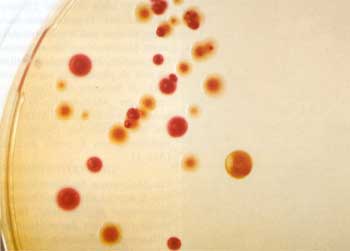
Schon früh war Mikrobiologen aufgefallen,
dass frische Pestisolate auf festen Nährböden bei 37°
C viel langsamer wachsen als bei 28° C, dass wenigstens zwei
Kolonietypen mit dem Auge erkennbar sind sowie dass die größeren
flachen Kolonien für Nagetiere viel weniger virulent sind als
die runden Formen mit dem glatten Rand. Darüber hinaus konnte
auch beobachtet werden, dass die virulenten Formen Hämin oder
Kongorot (Kongorot-Agar) speichern, was zur Bezeichnung des Phänotyps
„Pigmentation“ (Pgm) führte (Abb. 2).
Virulente Y. pestis zeigen ein
kalziumabhängiges Wachstum bei 37° C. Wird durch Zugabe
von Magnesiumchlorid/Natriumoxalat (10 mM/10 mM) dem Nähragar
Kalzium entzogen (MOX-Agar, Präzipitation von Ca-Oxalat), wachsen
die avirulenten Y. pestis bei 37° C nach 24 Std. zu sichtbaren
Kolonien heran, während die virulenten Yersinien nur mikroskopisch
zu erkennen sind [1]. Bei 28° C wachsen beide Formen auf MOX-Agar
gleich gut. Dieses Phänomen wird auch bei virulenten Y.
pseudotuberculosis und Y. enterocolitica beobachtet.
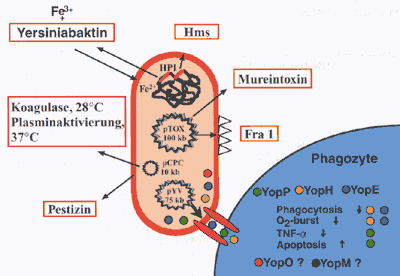
Verantwortlich für diesen Phänotyp ist das 70 Kilobasen
große Virulenzplasmid pYV, das bei allen drei Yersinia-Arten
vorkommt. Dieses Virulenzplasmid kodiert für ein Protein-Typ
III-Sekretionssystem, das die Yersinien befähigt, Pathogenitätsfaktoren
(die sog. Yersinia outer proteins, Yops) an der Erreger-Wirtzell-Kontaktzone
in das Zytoplasma zu translozieren [1]. Einige dieser Yops und ihre
zellulären Funktionen sind in Abbildung 3 dargestellt.
Bisherige Ergebnisse weisen darauf
hin, dass die Yops die Signaltransduktionskaskade, die normalerweise
nach Kontakt mit Bakterien zur Aktivierung der Zelle führt
(z.B. Phagozytose, Sauerstoffradikalbildung, TNF-alpha-Produktion),
hemmen und Makrophagen durch Apoptoseinduktion abtöten [6].
Darüber hinaus induziert das lange bekannte V-Antigen von Y.
pestis IL-10 in Makrophagen, was zur Immunsuppression führt
[7]. Y. pestis trägt noch zwei weitere Plasmide: pTOX
ist ein 100 Kb großes Plasmid, das für ein mausspezifisches
Toxin (Mtx, Lipase D) und ein Kapselprotein (Fraktion 1, Fra 1)
kodiert. Die Lipase D benötigen die Pestbakterien zum Überleben
und Vermehren im Flohmagen. pCPC ist 10 Kb groß und kodiert
für eine temperaturabhängige Protease, die Plasminogen
bei 37° C aktiviert und Fibrinbildung bei 28° C induziert.
Der Proteaseaktivität wird eine pathogenetische Bedeutung bei
der subkutanen Disseminierung zugeschrieben. Auf pCPC ist auch das
Gen, für das Bacteriocin Pestizin lokalisiert, das auf Yersinia
pseudotuberculosis Serotyp I, Y. enterocolitica Biotyp
I B sowie bestimmte E. coli-Stämme bakterizid wirkt
[8]. |
| Ökologie
und Epidemiologie
Bei der Pest handelt es sich um eine Zoonose von Nagetieren, die durch Flöhe übertragen wird. Der Rattenfloh (Xenopsylla cheopsis) infiziert sich durch Blut von septikämischen Ratten. Y. pestis kann im Vormagen des Flohs überleben und das Blut koagulieren. Wahrscheinlich führt dieser Zustand den Floh zu erneuter Blutmahlzeit. Nach dem Stich wird der infektiöse Mageninhalt herausgewürgt. Auf diese Weise wird der Pesterreger auf andere Wirte (Nagetiere, Haustiere, Menschen u. a.) übertragen. Je nach Widerstandsfähigkeit des Wirtes können Flöhe den Pesterreger dann weiter verbreiten. Zu den typischen Nagetieren in Wildpestgebieten
gehören Ratten, Feldmäuse, Ziesel, Erdhörnchen u.
a. Pestepidemien treten in der Regel dann auf, wenn der Pesterreger
in urbane Rattenpopulationen einbricht und eine Epizootie auslöst.
Die infizierten Rattenflöhe können dann Haustiere und
Menschen befallen. Von der Stichstelle aus gelangt der Pesterreger
in die nächstgelegenen Lymphknoten (z.B. untere Extremität,
Inguinallymphknoten). Innerhalb von 2 bis 6 Tagen entwickelt sich
eine schmerzhafte Lymphadenitis (Bubo) mit starker Schwellung und
schwerem Krankheitsgefühl. Die WHO hat die bekannten Wildpestherde
und die gemeldeten Pestfälle weltweit registriert [2].
1995 wurde in Madagaskar bei einem Jugendlichen mit Beulenpest ein multiresistenter Y. pestis, Biovar orientalis isoliert, der ein konjugatives Plasmid der Inc6-C-Gruppe mit Resistenzgenen gegen Betalaktam-Antibiotika, Chloramphenicol, Tetracyclin, Kanamycin, Streptomycin, Spectinomycin und Sulfonamide trägt. Dieser Stamm erwies sich in vitro noch empfindlich für Cephalosporine, Gentamicin, Chinolone und Trimethoprim. Der Patient überlebte nach Therapie mit Trimethoprim-Sulfamethoxazol. |
| Klinik
Die Pest manifestiert sich in drei unterschiedlichen Krankheitsbildern. 1. Beulenpest: 2. Primäre Pestsepsis: 3. Lungenpest: |
| Diagnostik
Eine Infektion mit Yersinia pestis setzt in der Regel einen Aufenthalt in einem Pestenzootiegebiet voraus. Dies ist bei der Anamneseerhebung zu berücksichtigen. Differentialdiagnostisch kommen bei fehlendem Bubo z.B. Malaria, Q-Fieber, Typhus, Fleckfieber, Brucellose und bei Lymphknotenschwellung oder Ulzeration z.B. Diphtherie und Tularämie in Frage. Bei Verdacht auf Pest sollten Kulturen
von Bubonen-Aspirat, Blut (2 bis 3 Blutkulturen innerhalb von 60
min) und ggf. Sputum oder Liquor angesetzt werden (Blutagar, BHI-Agar,
Mac-Conkey-Agar, Inkubation bei 28° C bis 48 Stunden). Obligat
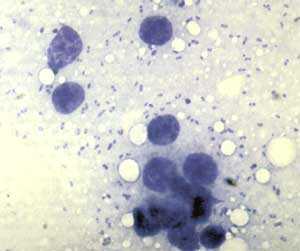
ist die Anfärbung von Patientenmaterial nach Gram und Wayson
(oder Methylenblau), um die typischen sicherheitsnadelförmigen
Pestbakterien mikroskopisch zu identifizieren. Da die meisten Pesterreger
das F1-Kapselprotein produzieren, können die Erreger mittels
Anti-F1-Serum in der Immunfluoreszenz spezifisch dargestellt werden.
Neuerdings können auch molekularbiologische Methoden wie PCR
und In-situ-Hybridisierung mit fluoreszierenden r-RNA-spezifischen
Proben (FISH-Technik) zum Direktnachweis von Pestbakterien herangezogen
werden [13]. Auch der Nachweis von F1-Antigen im Blut mittels ELISA
gehört zur Schnelldiagnostik der Pest, wogegen die serologische
Diagnostik (z.B. Nachweis von Serumantikörpern gegen F1-Antigen)
mehr von retrospektiver und epidemiologischer Bedeutung ist [1].
Hier sollte erwähnt werden, dass Y. pestis-Isolate nicht
selten als Y. pseudotuberculosis falsch identifiziert wurden
[1, 12]. |
| Therapie
und Prophylaxe
Für das Überleben des Pestpatienten
sind eine schnelle Diagnose und eine sofortige Antibiotikatherapie
entscheidend. Penicilline und Cephalosporine haben sich für
die Therapie der Pest als ineffizient erwiesen. Das wirksamste Antibiotikum
ist bis heute Streptomycin geblieben. Bei Pestmeningitis oder Streptomycin-Kontraindikation
ist eine Chloramphenicol-Therapie angezeigt. Auch Doxycyclin hat
sich als wirksam erwiesen. In Tabelle 4 sind die anerkannten Therapieprotokolle
angegeben. Patienten mit Verdacht auf Pestpneumonie müssen
nach Beginn der Antibiotikatherapie mindestens weitere 48 Stunden
isoliert werden.
Medizinisches Personal und andere Personen,
die Kontakt mit Pestpatienten haben, sollen prophylaktisch Tetracyclin/Doxycyclin
oder Trimethoprim-Sulfamethoxazol für 7 Tage einnehmen.
|
|
Gewinnung des Bubonen-Aspirats und Färbung nach Wayson 1. 1 ml Spritze mit 1 ml Kochsalzlösung
(steril) |
| Literatur:
1. Perry R.D., Fetherston J.D.: „Yersinia pestis – Etiologic Agent of Plague.“ Clin. Microbiol. Reviews 10 (1997) 35-66. 2. „Prevention of Plague.“ Recommendation of the Advisory Committee on Immunization Practices (ACIP) MMWR 45 (RR-14): (1996) 1-15. 3. Galimand M., Guiyoule A., Gerbaud G., Rasamanana B., Chanteau S., Carnie E., Courvalin P.: „Multidrug Resistance in Yersinia Pestis Mediated by a Transferable Plasmid.“ N. Engl. J. Med. 337 (1997) 667-680. 4. Ibrahim A., Goebel B.M., Liesack W., Griffiths M., Stackebrandt E.: „The phylogeny of the genus Yersinia based on 16S rDNA sequences.“ FEMS Micro. Letters 114 (1993) 173-178. 5. Rakin A., Heesemann J.: „The established Yersinia pestis biovars are characterized by typical patterns of I-Ceui restriction fragment length polymorphism.“ Mol. Genet. Microbiol. Virusol. 3 (1995) 26-29. 6. Ruckdeschel K., Harb S., Roggenkamp A., Hornef M., Zumbihl R., Köhler S., Heesemann J., Rouot B.: „Yersinia enterocolitica impairs activation of transcription factor NF-kB: Involvement in the induction of programmed cell death and in the suppression of the macrophage TNF-a production.“ J. Exp. Med. 187 (1998) 1069-1079. 7. Sing A., Roggenkamp A., Geiger A.M., Heesemann J.: „Yersinia enterocolitica Evasion of the Host Innate Immune Response by V Antigen-Induced IL-10 Production of Macrophages Is Abrogated in IL-10-Deficient Mice.“ J. Immunol. 168 (2002) 1315-1321. 8. Rakin A., Saken E., Harmsen D., Heesemann J.: „The pesticin receptor of Yersinia enterocolitica: a novel virulence factor with dual function.“ Mol. Microbiol. 13 (1994) 253-263. 9. Schubert S., Rakin A., Karch H., Carniel E., Heesemann J.: „Prevalence of the “High-Pathogenicity Island“ of Yersinia Species among Escherichia coli Strains That are Pathogenic to Humans.“ Infect. Immun. 66 (1998) 480-485. 10. Achtmann M., Zurth K., Morelli G., Torrea G., Guiyoule A.,. Carniel E.: „Yersinia pestis, the cause of plague, is a recently emerged clone of Yersinia pseudotuberculosis.“ Proc. Natl. Acad. Sci. USA 96 (1999) 14043-14048. 11. Parkhill J. et al.: „Genome sequence of Yersinia pestis, the causative agent of plague.“ Nature 413 (2001) 523-527. 12. Anonymus: „Fatal Human Plague – Arizona and Colorado, 1996.“ MMWR 46 (1997) 617-620. 13. Hinnebusch J., Schwan T.G.: „New Method for Plague Surveillance Using Polymerase Chain Reaction To Detect Yersinia pestis in Fleas.“ J. Clin. Microbiol. 31 (1993) 1511-1514. 14. Trebesius K.-H., Harmsen D., Rakin A., Schmelz J., Heesemann J.: „Development of rRNA targeted PCR and in situ hybridization with fluorescently labelled oligonucleotides for detection of Yersinia species.“ J. Clin. Microbiol. 36 (1998) 2557-2564. |
| Anschrift der Verfasser:
Prof. DDr. J. Heesemann, Dr. A. Rakin Max von Pettenkofer-Institut für Hygiene und Medizinische Mikrobiologie D-80336 München, Pettenkoferstraße 9a E-Mail: heesemann@m3401.mpk.med.uni-muenchen.de, rakin@m3401.mpk.med.uni-muenchen.de |