| Mikrobiologische Diagnostik von Milzbrand |
|
D. Khaschabi, M. Schönbauer |
| Schlüsselwörter:
Anthrax, Milzbrand, Diagnose, Ascoli |
|
Bei Beachtung all dieser Kriterien ist eine schnelle und sichere Diagnose leicht möglich. |
Key-words: Anthrax, diagnosis, Ascoli |
|
Taking into consideration the above microbiological techniques a quick and safe diagnosis of anthrax is easily achievable. |
| Einleitung
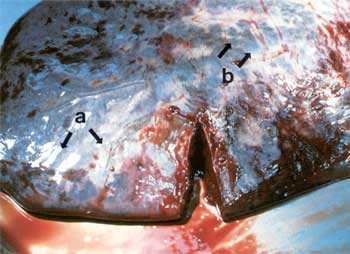
Der Milzbrand, Anthrax (Abb. 1), ist eine Zoonose, die durch den Erreger Bacillus anthracis hervorgerufen wird. Es ist eine primär bei Tieren, vor allem Haus- und Nutztieren vorkommende, akute Infektionskrankheit, die – meistens vom Tier – auf den Menschen übertragen werden kann. Zusammengefasste Literatur findet sich bei Blobel und Schließer [1]. Die vorliegende Arbeit stellt eine
Zusammenfassung der mikrobiologischen Nachweisverfahren und Differenzierungsmethoden
dar.
|
| Die
Probennahme
Bei der Probenziehung ist grundsätzlich zu unterscheiden, ob es sich um Material- oder Umweltproben oder um klinische Proben handelt. Die Aufarbeitung aus Material- und Umweltproben gestaltet sich schwierig und erfordert einige Übung und Erfahrung. Im Unterschied dazu ist aus klinischem Material die Anzucht in der Regel ohne Schwierigkeiten möglich, sowohl aus Karbunkeln, Blutproben oder Organabstrichen. In Verbindung mit den Krankheitszeichen und dem pathologischen Befund reicht in der Regel der mikroskopische Nachweis bekapselter Zellen (Bambusform) in den Organen aus, um die Diagnose zu erhärten. Die in der Tiermedizin übliche Vorgangsweise der Einsendung eines abgebundenen und an der Schnittfläche abgebrannten Ohres des Tierkadavers sollte in dieser Form nicht mehr ausgeführt werden, vielmehr ist bei an Milzbrand gefallenen Tieren Blut durch Punktion eines großen Gefäßes mittels einer Einmalspritze zu gewinnen, welche mit einem Kanülenschutz fest verschlossen, abgeklebt und gut verpackt, mit einem entsprechenden Warnhinweis versehen, in das Labor gebracht wird. Die Anzucht erfolgt auf Blutagar sowie auf Nähragar. |
| Der
Erreger
B. anthracis ist ein aerober und fakultativ anaerober Sporenbildner. Er ist ein unbewegliches, zylindrisches, grampositives Stäbchen von 3 - 5 µm Länge und 1 µm Breite. Mit den als „Pseudomilzbrandbazillen“ bezeichneten Arten B. cereus, B. mycoides und B. megaterium ist er morphologisch leicht zu verwechseln. In vivo sind die Stäbchen eher kurz, leicht abgerundet, einzeln oder in kurzen Ketten angeordnet. In der Kultur werden lange Fäden aus unbekapselten Bazillen gebildet. Milzbrandbazillen wachsen auf allen gebräuchlichen festen Nährböden und bilden nach 24 Stunden aerober Bebrütung bei 37° C oberflächliche, mittelgroße, matte Kolonien von grauweißlichem Aussehen. Auf der Agaroberfläche bilden virulente Stämme die charakteristischen Ausläufer (Medusenhaupt), die in kleinerem oder größerem Bogen zur Kolonie zurückkehren oder sich nur wenig vom Rande der Kolonie entfernen. Die Ausläufer bestehen aus kettenförmig aneinander gelagerten Stäbchen. Die Milzbrandsporen haben eine ellipsoide Form, sind 0,7 - 0,8 µm dick und ca. 1,5 µm lang. Sie liegen zentral ohne Auftreibung in der Zelle. Die Sporulation erfolgt nur außerhalb des Körpers bei Anwesenheit von Sauerstoff und einer Temperatur von über 12° C und in der Kultur am Schluss der logarithmischen Phase nach 24 bis 48 Stunden, besonders bei üppigem Wachstum. Die Virulenz des Erregers ist abhängig von der Kapselbildung und dem Anthrax-Toxin. In vivo wird eine Kapsel gebildet, die mit Spezialfärbungen darstellbar ist. In vitro wird die Kapsel nur unter bestimmten Voraussetzungen (CO2-Spannung, Na-Bicarbonat-Zusatz) gebildet. |
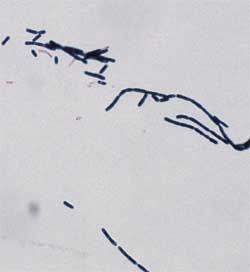
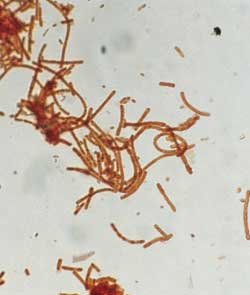
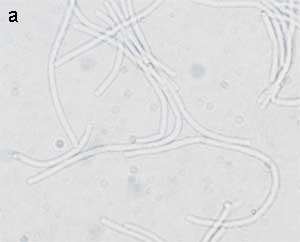
| Gramfärbung
Direkter Nachweis von B. anthracis
in Blut- und Organabstrichen oder Kulturausstrichen: Plumpe, grampositive
Stäbchen mit ausgesprochener Neigung zur Fadenbildung (Bambusform).
Grampositives Verhalten (Abb. 2) kann mit dem Alter verloren gehen,
und dort, wo Gramlabilität vorkommt, waren die Zellen in den
früheren Wachstumsstufen grampositiv. Die Gram-Färbung
sollte daher so bald wie möglich durchgeführt werden,
d.h. gewöhnlich innerhalb von 24 Stunden nach Ausstreichen
und Inkubation auf Blutagar.
|
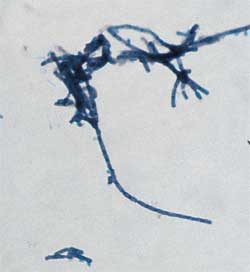
| Sporenfärbung
Für Routinezwecke sind Kulturen
auf Blutagarplatten, die 2 - 4 Tage bei Zimmertemperatur aufbewahrt
wurden, ausreichend, um Sporulation und Sporenmorphologie beobachten
zu können. Zum Nachweis der Sporen eignet sich die Sporenfärbung
nach Rakette (Abb. 3).
Durchführung der Sporenfärbung
nach Rakette [2]: Die Bakterienzellen färben sich rot, die Sporen grün. Die Form und die Position der Sporen werden beurteilt. |
| Wachstum
in Bouillon
In flüssigen Nährmedien wächst
B. anthracis als flockiger, watteartiger Bodensatz ohne Häutchenbildung,
während die überstehende Flüssigkeit gewöhnlich
klar bleibt (Abb. 4). Wenn keine Verunreinigung zu befürchten
ist, gibt zudem das charakteristisch flockige Wachstum in Bouillon
ohne Trübung der überstehenden Nährlösung wertvolle
diagnostische Hinweise [3].
|
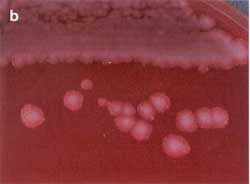
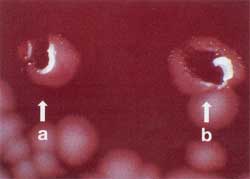
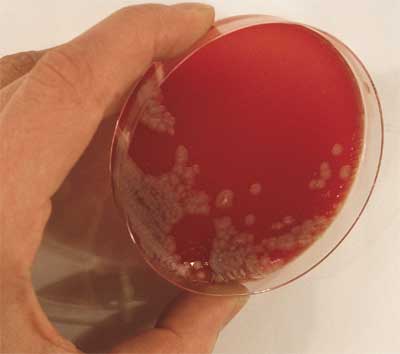
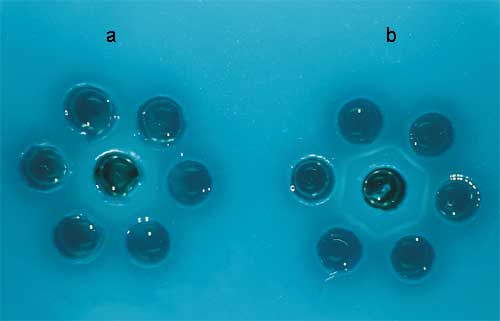
| Koloniemorphologie
auf Normalagar und Blutagar
Die Anzüchtung erfolgt auf Blutagar,
die typischen Kolonien sind leicht zu erkennen. Die Milzbrandzellen
bilden nach Bebrüten über Nacht große (2 - 5 mm)
weiße Kolonien mit rauer Oberfläche. Auf Blutagar wird
keine Hämolyse gebildet, allenfalls erfolgt eine leichte Aufhellung
unter der Kolonie. Ausläufer am Kolonierand sind häufig
zu finden (Medusenhaupt), aber nicht immer (Abb. 5a und b).
|
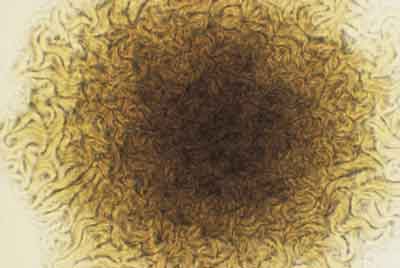
| Medusenhaupt
Man legt ein Deckglas auf junge Kolonien
auf einer Agaroberfläche (Standard-Nähragar) und untersucht
die Ränder der Kolonien mit einem 10er Objektiv. Die Kolonien
sind an ihren Rändern von ausstrahlenden, bogenförmig
gewundenen, lockigen oder zopfartigen Ausläufern umgeben. Für
Kolonien der gesamten B. cereus-Gruppe ist dies ein häufiges
Merkmal, das sowohl bei Kolonien vieler B. cereus-, B.
thuringiensis- und B. cereus var. mycoides-Stämme
als auch bei B. anthracis-Stämmen auftreten kann (Abb.
6).
|
| Sonstige
Eigenschaften der Kolonie von B. anthracis
Eine weitere, diagnostisch bedeutsame
Erscheinung lässt sich im Zusammenhang mit dem Abimpfen von
Koloniematerial mittels der Öse feststellen (Abb. 7). Wird
mit der Öse oder Impfnadel unter einen der Ausläufer einer
Milzbrandkolonie gefahren und dieser von der Nährbodenoberfläche
abgehoben, bleibt er steif wie geschlagenes Eiweiß stehen
– Eischnee-Effekt [4]. Ebenso kann bei Abimpfen von Koloniematerial
festgestellt werden, dass sowohl der auf dem Nährboden verbleibende
Teil der Kolonie als auch das an der Öse haftende Koloniematerial
eine steife, spitz auslaufende „Nase“ zieht, die nicht
abknickt oder in sich zusammenfällt [5]. Das Koloniematerial
von B. cereus ist wesentlich weicher und zeigt diese Erscheinung
nicht, die Kolonien von B. cereus var. mycoides haften so
fest auf dem Nährboden, dass sich von ihnen nicht genügend
Material zur Durchführung dieser Prüfung entfernen lässt.
|
| Abgrenzung
von ähnlichen Arten
Alle Versuche zur biochemischen Abgrenzung
des Milzbranderregers von anderen aeroben Sporenbildnern sind bisher
wenig erfolgreich gewesen. Auch das API-50 CHB-System von BioMerieux
ist zur Differenzierung zwischen B. anthracis und seinen
Verwandten aus der Cereusgruppe nur beschränkt geeignet. |
| Beweglichkeit
B. anthracis ist unbeweglich. Obwohl verschiedene Nachweismethoden für die Motilität zur Verfügung stehen, sind die beiden zuverlässigsten das Wachstum in halbfestem Agar und die Methode des hängenden Tropfens. Für den hängenden Tropfen sollten junge (4 - 7 Stunden), bei 30° C bebrütete Nährbouillonkulturen im konventionellen, hängenden Tropfen mit einem starken Objektiv oder, sofern vorhanden, im Phasenkontrast untersucht werden. |
| Phagentest
Beim Phagentest (Abb. 8) lassen sich
sehr gute Resultate mit der Anwendung des y-Phagen erzielen [6].
Der Test lässt sich von einer 3- bis 4-stündig bebrüteten
Vorkultur in Nährbouillon genauso gut durchführen wie
von einer leicht trüben Suspension des verdächtigen Koloniematerials
in steriler physiologischer Kochsalzlösung oder auch mit dem
unsuspendierten Koloniematerial direkt. Stets sollte jedoch als
positive Kontrolle ein bekannter Milzbrandstamm und als negative
Kontrolle ein Stamm von B. cereus bei gleicher Präparationstechnik
in die Untersuchung mit einbezogen werden. Auf der Rückseite
einer Petrischale mit Blutagar werden mit der Schablone kreisrunde
Flächen mit einem Durchmesser von 2,0 cm markiert. Auf je eine
der Kreisflächen wird mit der Öse das Probenmaterial möglichst
gleichmäßig verteilt. Dann wird der Inhalt einer Platinöse
(im Durchmesser 3 mm) mit Phagensuspension exzentrisch auf diesen
Bereich auslaufen gelassen, wobei bei der Verwendung flüssiger
Bakterienzellpräparationen diese erst auf dem Nährboden
angetrocknet sein müssen, bevor der Phage aufgebracht wird.
Der Ansatz wird 7 - 8 Stunden bei 37° C bebrütet und dann
abgelesen. Bei positivem Phagentest ist an der Stelle, wo die Phagensuspension
aufgetropft wurde, ein vom Bakterienzellrasen freier Bereich zu
sehen. In speziellen Fällen, in denen keine Verunreinigung
des Materials zu erwarten ist, z.B. bei post mortem durch Venenpunktion
gewonnenem Blut oder unter sterilen Kautelen präparierten Milzstückchen
der für den Tierversuch verwendeten Mäuse, kann der Phagentest
direkt mit dem Probenmaterial durchgeführt werden, indem das
Material analog der oben beschriebenen Methodik auf der Agaroberfläche
ausgestrichen wird [7].
|
| Kapselbildung
B. anthracis-Keime besitzen so lange keine Kapseln, bis sie unter Bedingungen, die die Kapselbildung fördern, wachsen. Die Untersuchung auf Kapseln in den Blut- oder Organabstrichen von milzbrandverdächtigen Tieren und Labortieren, die für Pathogenitätstests und zur Reisolierung inokuliert wurden, wird nach Olt durchgeführt [2]: 1. Hitzefixiertes Präparat
färben mit 3% wässriger Safraninlösung. Nachweis der Kapselbildung auf Trypticase Soy Agar (TSA) mit 0,9% Natriumbicarbonat. (Ist kein solcher Agar vorrätig, kann auch normaler Nähragar benutzt werden, auf den eine entsprechende Menge steril filtrierter 9%iger Natriumbicarbonatlösung ausgespatelt wurde – Endkonzentration 0,9%.) Auf die Agaroberfläche wird Material der verdächtigen Kolonie ausgestrichen. Die Platte wird in ca. 5%iger CO2-Atmosphäre bebrütet (2 Tage, 37° C). Dann wird die Kultur mit 10%iger Formaldehydlösung überschichtet, nach einer Einwirkungszeit von 1 h abgeschwemmt und in ein Reagenzglas überführt. Eine kleine Öse (ca. 1 µl) wird von dieser Suspension auf einen Objektträger übertragen und mit ebenso wenig Zeichentusche vermischt, dann wird ein Deckglas aufgelegt und so angedrückt, dass eine dünne, durchscheinende Schicht entsteht. Mit dem Mikroskop können dann die dicken Kapseln als partikelfreie Räume um die Milzbrandfläche dargestellt werden (Abb. 9, 10).
|
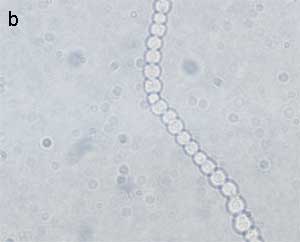
| Perlschnurtest
Der Perlschnurtest (Abb. 11a und b) kann zur schnellen Erkennung von Milzbrandbazillen beitragen. Dieser Test besitzt für die Diagnose des Milzbrandes eine relativ große Aussagekraft, allerdings muss auch mit dem Auftreten penicillinresistenter Stämme gerechnet werden, wodurch die Beweiskraft etwas eingeschränkt wird. Die Methode beruht darauf, dass es unter Penicillineinwirkung zur Bildung kugelig deformierter Milzbrandzellen kommt, die sich entweder knäuelig zusammenlagern oder so angeordnet sind, dass sie einer Perlschnur gleichen. Hierzu wird die Oberfläche je
einer Müller-Hinton-Agarplatte oder Standard-Nähragar
mit 0,1 ml einer Vorkultur der zu untersuchenden Isolate und des
bekannten Kontrollstammes gleichmäßig beimpft. In der
Mitte der Platte wird ein Plättchen aufgelegt, das 10 IE Penicillin
enthält. Der Ansatz wird 3 - 6 Stunden bei 37° C bebrütet,
und dann wird ein Agarstück zur Untersuchung im Grenzbreich
der Hemmzone herausgeschnitten, auf einen Objektträger gelegt,
mit einem Deckglas versehen und unter dem Mikroskop mit dem Ölimmersionsobjektiv
(60- bis 100fache Vergrößerung) betrachtet. Befinden
sich im Grenzbereich der Hemmzone die typischen kugeligen Zellformen,
ist der Test positiv [8, 4].
|
| Serologischer
Nachweis von B. anthracis-Antigenen
Die Thermopräzipitation nach Ascoli
[9] wird immer dann angewandt, wenn ein kultureller Nachweis des
Erregers nicht möglich ist. Wenn Milzbrandbazillen in den Organen
z.B. aufgrund fortgeschrittener Fäulnis mikroskopisch nicht
mehr erfassbar sind, kann die Ascoli-Präzipitation durchgeführt
werden. Sie kann auch zur Bestimmung von Milzbrandstämmen benutzt
werden. Die Methode beruht auf dem Nachweis gelöster spezifischer
Milzbrandantigene durch die Präzipitation. Zur Durchführung
der Reaktion werden 2 bis 3 g zerkleinertes Organmaterial kurz aufgekocht
und durch Papierfilter klar filtriert. In kleinen Präzipitationsröhrchen
wird zuerst das präzipitierende Milzbrandserum mit einer Kapillare
auf den Röhrchenboden gebracht und dann der klare Extrakt auf
das Serum geschichtet. Im positiven Falle bildet sich innerhalb
weniger Minuten an der Berührungsfläche ein Präzipitationsring.
Die Reaktion kann auch als Agargelpräzipitation nach Ouchterlony
(Abb. 12) durchgeführt werden [10]. Die Thermopräzipitation
ist keine eindeutig beweisende diagnostische Methode, weil auch
positive Reaktionen durch Antigene aus B. cereus und B.
laterosporus vorgetäuscht werden können.
|
| Tierversuch
zu diagnostischen Zwecken
Im Zweifelsfall kann auch ein Tierversuch zum Nachweis der Pathogenität durchgeführt werden. Zur Absicherung der Diagnose reicht nach unserer Auffassung die Durchführung von einem Teil der oben beschriebenen Untersuchungen völlig aus. Bei einem Neuausbruch erscheint es jedenfalls sinnvoll, auch eine Charakterisierung des Isolates vorzunehmen, die aber stets Speziallabors vorbehalten ist. |
| Vorsichtsmaßnahmen
Unter normalen Laborbedingungen ist das Infektionsrisiko für das Personal jedenfalls nicht größer als bei der Arbeit mit anderen pathogenen Erregern auch. Bei Unfällen ist die sofortige Therapie mit Penicillin oder anderen Antibiotika angezeigt. Sämtliche Verbrauchsmaterialien und Abfälle sind jedenfalls thermisch zu beseitigen, da die Sporen des B. anthracis eine ungewöhnlich hohe Tenazität und eine ganz erhebliche Thermoresistenz aufweisen und im normalen Erdboden gut 100 Jahre und mehr (!) infektionstüchtig überleben. Da B. anthracis auch als biologische Waffe zu berüchtigter Berühmtheit gekommen ist, muss bei der Asservierung von Stämmen und Isolaten die höchstmögliche Sicherheit gefordert werden, weil sich dieser Erreger durchaus auch für kriminellen Missbrauch eignet. Derartige Isolate sind daher unter Verschluss zu halten, zu codieren und damit für nicht ausgewiesene Experten unkenntlich zu machen. Auch empfiehlt es sich, für alle nur denkbaren Fälle einen Alarmplan zu entwickeln und die Mitarbeiter entsprechend zu schulen. |
| Literatur:
1. Böhm R.: „Milzbrand.“ Aus: Blobel H. und Schließer T.: „Handbuch der bakteriellen Infektionen bei Tieren.“ Gustav Fischer Verlag, Stuttgart Bd. IV (1982) 259-331. 2. Winkle St.: „Mikrobiologische und serologische Diagnostik.“ Gustav Fischer Verlag, Stuttgart (1979) 88. 3. Seidel G.: „Die aeroben Sporenbildner unter besonderer Brücksichtigung des Milzbrandbazillus.“ In: Habs H. und Kathe J.: „Beiträge zur Hygiene und Epidemiologie.“ Heft 17. Johann Ambrosius Barth, Leipzig (1963). 4. Feeley J.C. and Patton C.M.: „Bacillus.“ In: Lennette E.H., Balows A., Hausler J.R.W.J. and Truant J.P.: „Manual of Clinical Microbiology.“ American Society for Microbiology, Washington D.C. 3ed. (1980) 145-149. 5. Hailer E., Heicken K.: „Untersuchungen zur Bekämpfung des gewerblichen Milzbrandes.“ VIII. Mitt. Z. Hyg. 137 (1953) 611-639. 6. Brown E.R., Cherry W.B.: „Specific identification of Bacillus anthracis by means of a variant bacteriophage.“ J. Infect. Dis. 96 (1955) 34-39. 7. Kielwein G.: „Ein Vorschlag zur praktischen Differenzierung des Bacillus anthracis durch den Phagentest.“ Tierärztl. Umsch. 12 (1957) 183-186. 8. Bailie W.E., Stowe E.C.: „Simplified test for identification of Bacillus anthracis.“ In: „Proceedings Abstracts of annual meeting.“ Am. Soc. Microbiol. (1977) 48. 9. Ascoli A.: „Die Präzipitation bei Milzbrand.“ Zbl. Bakt. I. Orig. 58 (1957) 63-70. 10. Mathois H.: „Zur Anwendung der Agardoppeldiffusion in der Milzbranddiagnostik.“ Mh. Tierhk. 14 (1962) 407-412. |
| Anschrift
des Verfassers: Dr. Daryusch Khaschabi Bundesanstalt für veterinärmedizinische Untersuchungen A-6020 Innsbruck, Langer Weg 27 E-Mail: khaschabi@hotmail.com |