| Diabetische Neuropathie: Ursachen, Klinik und Diagnostik |
| I. Podreka Krankenanstalt Rudolfstiftung, Neurologische Abteilung, Wien (Vorstand: Prim. Univ.-Prof. Dr. I. Podreka) |
|
Neuropathien, die sich als Spätkomplikation beim Diabetes mellitus entwickeln können, treten einerseits häufig auf, andererseits können sie in ihrer Symptomatik äußerst komplex sein. Eine systematische Übersicht lesen Sie im folgenden Beitrag. Die Prävalenz der diabetischen Neuropathie ist nicht genau bekannt und wird mit etwa 12,7 bis 54% bei Typ-1-Diabetikern und 17,2 bis 45% bei Typ-2-Diabetikern geschätzt. Etwa die Hälfte der Patienten mit insulinpflichtigem Diabetes mellitus leiden an einer symptomatischen Neuropathie. Zum Zeitpunkt der Diagnosestellung kann bei Patienten im Alter unter 40 Jahren selten eine Neuropathie angetroffen werden, während bei älteren Patienten dies häufiger der Fall ist. Prinzipiell sollten aber bei nachgewiesener Polyneuropathie bei Diabetespatienten auch andere Polyneuropathieursachen ausgeschlossen werden, da in 6-10% der Fälle eine Komorbidität mit anderen Erkrankungen vorliegt. |
|
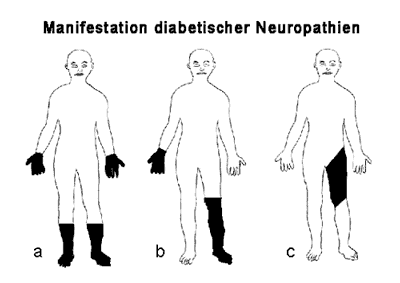
Schmerzlose Form Klinische Symptome sind zuerst an den unteren Extremitäten symmetrisch auftretende, sockenförmig begrenzte Sensibilitätsstörungen. Dabei sind Berührungs-, Lage- und Vibrationssinn betroffen (markreiche Nervenfasern mit schneller Erregungsleitung). Die Patienten berichten über ein Gefühl des „Ameisenlaufens“, des Kribbelns, über Bamstigkeit oder über eine Spannung in den Füßen und Waden. Da das zweite motorische Neuron betroffen ist, sind die Sehnenreflexe abgeschwächt bis fehlend, insbesondere der Achillessehnenreflex (siehe Abbildung 3a). Bei ausgeprägter Störung des Lagesinns kann eine Ataxie im Vordergrund stehen, man spricht von einer „Pseudotabes diabetica“. Schmerzhafte Form Hier klagen die Patienten über brennende Sensationen in den Füßen (burning feet) und Wadenkrämpfe, vor allem nachts. Die Störung des Temperatursinnes bedingt unangenehme Wärme- und Kälteparästhesien. Hier liegt eher eine Störung der markarmen, langsam leitenden Nervenfasern vor. Jede Berührung der affizierten Hautabschnitte wird als unangenehm empfunden (Hyperpathie), weshalb nachts der Druck der Bettdecke auf die Füße kaum ertragen wird. In vereinzelten Fällen können die Muskeleigenreflexe noch erhalten sein. Sind vegetative Nervenfasern mitbetroffen, entwickeln sich trophische Störungen der Haut. Paretische Form Neben den anderen oben beschriebenen Symptomen treten hier distal betonte Paresen und mit fortschreitender Erkrankung auch Muskelatrophien auf. Mononeuropathia multiplex Diese diabetische Neuropathieform betrifft mehrere einzelne Nerven in nicht symmetrischer Weise. Es treten Lähmungen und Sensibilitätsstörungen im Versorgungsgebiet dieser Nerven auf (z.B. an der oberen Extremität N. radialis, medianus und ulnaris, an der unteren N. femoralis und peronaeus; siehe Abbildung 3b). Proximale, asymmetrische diabetische Neuropathie (diabetische Amyotrophie) Sie ist viel seltener als die oben angeführte symmetrische Form. Es treten eher plötzlich Muskellähmungen auf (Oberschenkel und Beckengürtel), die von starken Schmerzen besonders nachts im Versorgungsbereich der betroffenen Nerven (häufig N. femoralis) begleitet sind. Der entsprechende Sehnenreflex (z.B. Patellarsehnenreflex) ist abgeschwächt bis erloschen (siehe Abbildung 3c). Das Krankheitsbild kann mit einem Bandscheibenleiden verwechselt werden. Gelegentlich können auch einzelne Rumpfmuskeln eine Schwäche aufweisen. Sensibilitätsstörungen treten selten auf und sind weniger stark ausgeprägt als bei radikulären Kompressionssyndromen. Hält die Lähmung länger an, so sind auch Atrophien der Muskeln nachweisbar. Im Allgemeinen bildet sich jedoch die Symptomatik nach mehreren Wochen zurück.
Plötzlich auftretende Doppelbilder, die von einem deutlichen Orbitalschmerz begleitet sein können, sind hier das führende Symptom. Am häufigsten betroffen sind der N. oculomotorius und der N. abducens, selten der N. trochlearis. Meist sind die Lähmungen einseitig lokalisiert, wobei sich selten und nacheinander auftretend auch beidseitige Paresen entwickeln können. Die Prognose ist in der Regel gut, die Lähmungen bilden sich innerhalb von 2 bis 3 Monaten auch spontan zurück. Paresen anderer Hirnnerven kommen beim Diabetes mellitus kaum vor und wenn, bleibt ihr Zusammenhang mit der Grunderkrankung fraglich. Affektion des autonomen Nervensystems Beim Diabetes mellitus können Miktionsstörungen durch Sphinkterinsuffizienz oder durch eine atone Blase auftreten. Etwa die Hälfte juveniler Diabetiker klagt bei langer Krankheitsdauer über Impotenz. Herzrhythmusstörungen, auch eine Störung der Schweißsekretion, orthostatisch bedingte Hypotonie, Störungen der Pupillomotorik und der Tränensekretion und das nächtliche Auftreten von Diarrhoen werden beobachtet. Vegetative Störungen treten selten isoliert auf. Meist sind sie mit anderen, zuvor beschriebenen Neuropathiesymptomen vergesellschaftet. |
|
Neben der klinisch-neurologischen Untersuchung sind elektrophysiologische Untersuchungstechniken, wie die Messung der Nervenleitgeschwindigkeit (NLG) und die Elektromyographie (EMG) für die Diagnose diabetischer Neuropathien wichtig. Abnorme NLG-Befunde können auch bei noch asymptomatischen Patienten gefunden werden. Die Verzögerung der NLG wird meist an den unteren Extremitäten nachgewiesen und muss nicht unbedingt der Schwere der vorliegenden Neuropathie entsprechen. Eine bessere Korrelation zum Ausmaß der Nervenschädigung erhält man durch quantitative NLG-Methoden. Dabei findet man eine Verminderung der Amplituden motorisch und sensorisch evozierter Potenziale, die proportional zur axonalen Degeneration ist. Der Nachweis einer Muskeldenervation durch die EMG kann mitunter diagnostisch sensitiver sein als die NLG-Messung. Bei Vorliegen einer diabetischen Amyotrophie und Mononeuropathia multiplex kann die Läsion der betroffenen Nerven und Muskeln mit beiden Untersuchungsmethoden gut dokumentiert werden. Leider sind die NLG-Messung und die EMG nicht sehr sensitiv, wenn die Neuropathie durch Schädigung nicht-myelinhaltiger Nerven bedingt ist. Hier können Messungen der Herzfrequenzvariabilität bei Valsalvaversuch und quantitative Messungen der Temperaturempfindung diagnostisch hilfreich sein. Die Rochester Diabetic Neuropathy Study Group hat Kriterien für die Diagnose einer diabetischen Neuropathie erarbeitet. Diese stützen sich einerseits auf das klinische Bild (neuropathische Symptome, neuropathische Defizite) und andererseits auf elektrophysiologische Befunde (pathologische NLG, quantitativ erfasste Störungen der Sensibilität, quantitativ erfasste Störung des autonomen Systems). Mindestens zwei dieser fünf Punkte müssen erfüllt sein, um die Diagnose einer diabetischen Neuropathie stellen zu können. |
| Anschrift des Verfassers:
Prim. Univ.-Prof. Dr. Ivo Podreka Krankenanstalt Rudolfsstiftung, Neurologische Abteilung A-1030 Wien, Juchgasse 25 |