| Therapieoptionen
Prognosekriterien
bei Peritonitis sind die Ausdehnung der Infektion (lokale Infektion
– geringes Risiko, systemische Infektion – hohes
Risiko), ob der Fokus bei generalisierter Peritonitis saniert
werden kann und ob im Krankheitsverlauf Organversagen auftritt.
Ein nicht zu beeinflussender Risikofaktor ist das Patientenalter.
Chirurgische Therapie
Bis in die 1920er-Jahre wurden ausschließlich konservative
Verfahren angewendet. 1926 erschien die maßgebliche Untersuchung
von Martin Kirschner (Arch Klin Chir 1926; 142: 253-309),
in der bereits im Wesentlichen die bis heute gültigen chirurgischen
Behandlungsprinzipien definiert wurden. Zuerst erfolgt die Herdsanierung
zur Ausschaltung der Infektionsquelle, danach die Peritonaltoilette
– die Reinigung der Abdominalhöhle mittels mechanischer
Entfernung von Detritus und Ingesta und anschließender
Spülung mit physiologischer Kochsalzlösung ohne Zusatz
von Antibiotika oder Antiseptika. Danach muss der Operateur
den weiteren Verlauf abschätzen und gegebenenfalls ein
Verfahren zur Infektionskontrolle festlegen.
Wie wichtig die Herdsanierung ist, zeigen die Ergebnisse von
zwei Studien zur Mortalität in Abhängigkeit vom Zeitpunkt
der Herdsanierung (Götzinger P. et al Langenbecks Arch
Chir. 381: 343-347; 1996; Koperna T. Schulz F, World J. Surg
24: 32-43; 2000). Gelingt die Herdsanierung bereits mit der
ersten Operation, liegt die
Mortalität der Patienten zwischen 5 und 10%, sind jedoch
weitere Operationen notwendig, steigt diese auf 25 bis 50%.
Gelingt die Sanierung des Infektionsherdes nicht, versterben
die Patienten in den meisten Fällen.
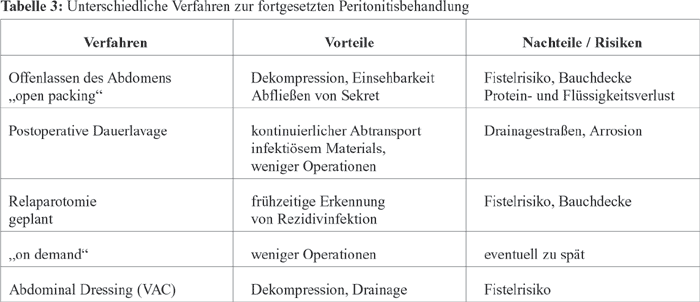
Zur fortgesetzten Peritonitisbehandlung stehen unterschiedliche
Verfahren zu Verfügung. Wurde in den 1970ern das Offenlassen
des Abdomens angewendet, ging man in den 1980ern zur postoperativen
Dauerlavage über. Eine prospektiv randomisierte Studie
von Hallerbeck B et al (Surgery Gynecol Obstet 1968, 163: 433-36)
erbrachte jedoch, dass mit diesem Verfahren keine Outcome-Verbesserung
erreicht wird. Als Relaparotomievarianten kommen das geplante
(z. B. im 48-Stunden-Rhythmus), oder das bedarfsorientierte
„on demand“-Verfahren in Betracht. Die heute gültige
Empfehlung, Patienten vorrangig „on demand“ zu relaparotomieren,
stützt sich auf Ergebnisse
von
drei Studien (Hau T et al 1995, Arch Surg 130:1193-97; Lamme
B et al 2004, Br. J Surg 91:1046-1054; van Ruler et al 2007
JAMA 298: 865-873). Ein Vergleich Relaparatomie „on demand“
versus geplanter Operation erbrachte zwar keinen Unterschied
bezüglich der Mortalität, zeigte aber mehr Komplikationen
(Bauchdeckenkomplikationen, Fistelrisiko und Blutung), längere
Krankenhausaufenthalte und höhere Kosten bei geplanter
Operation.
Ein weiteres Verfahren, das Abdominal Dressing (VAC –
Vaccum Assited Closure), wird nicht routinemäßig,
sondern nur bei Patienten mit abdominellem Kompartment angewendet.
Antibiotische Therapie
Für die antibiotische Therapie der spontanen bakteriellen
Peritonitis werden Cephalosporine der 3. Generation, alternativ
Chinolone oder Piperazillin/Tazobactam empfohlen. Für eine
AB-Prophylaxe nach der ersten Episode gibt es gegenwärtig
keine Evidenz.
Bei
community acquired Perforationsperitonitis geringer bis mäßiger
Schwere werden als Monotherapie verschiedene Cephalosporine
oder Kombinationspenicilline oder Ertapenem empfohlen oder als
Kombinationstherapie Cefazolin oder Cefuroxim + Clindamycin
oder Metronidazol; Quinolon + Clindamycin oder Metronidazol.
Für schwere Infektionen oder bei potenziell resistenten,
Gram-negativen Keimen werden als Monotherapie Imipenem-Cilastin,
Meropenem, Doripenem, Piperazillin/Tazobactam oder als Kombinationstherapie
Ciprofloxacin oder Aztreonam oder Aminoglycosid + Metronidazol
oder Clindamycin empfohlen. Aminoglycoside sollten jedoch aufgrund
ihres Risikoprofils nur sehr zurückhaltend eingesetzt werden.
Eine Metaanalyse aus 36 Studien der Cochrane Library 2008 für
CAPDPeritonitis hatte zum Ergebnis, dass intraperitoneal applizierte
Antibiotika besser wirken als intravenös verabreichte,
in der Zusammenfassung weisen die
Autoren jedoch darauf hin, dass sich diese Empfehlung nur auf
die Daten einer Studie stützt. In einer weiteren Analyse
der Cochrane Library 2009 mit 40 Studien zur sekundären
Peritonitis mit 5.094 Patienten kommen die Autoren zur Überzeugung,
dass Antibiotika ihren Platz in der adjuvanten Therapie der
chirurgisch sanierten Peritonitis haben, es aber nicht gelingt,
eine Überlegenheit für ein Antibiotikum nachzuweisen.
Zusammenfassend kann daher festgestellt werden, dass die Datenlage
zur Antibiotikatherapie bei Peritonitis je nach Form sehr inhomogen
ist und die therapeutischen Entscheidungen weiterhin auch maßgeblich
individuell getroffen werden müssen.
|