|
Das beste Medikament in der Behandlung von S. aureus
ist Penicillin, alles andere wirkt zumindest 10 x schlechter.
Vancomycin dagegen ist ein schlechtes Antibiotikum – wäre
da nicht MRSA.
Ich will nun darüber referieren, warum S. aureus
uns Probleme macht, basierend auf der modernen molekularbiologischen
Grundlagenforschung.
Das Hauptproblem in der S. aureus-Epidemiologie steht
irgendwie in Wechselwirkung mit MRSA. Es existieren unterschiedlichste
Prävalenzen weltweit (Folie 1), einige Länder zeigen
besonders niedere Resistenzraten wie z.B. die Niederlande, jedoch
gibt es dort einen Anstieg von MRSA zu verzeichnen – wie
ich später berichten werde. Deutschland hingegen befindet
sich auf einem Plateau, Tendenz sinkend. Konsequente Hygiene
scheint Wirkung zu zeigen. Allerdings muss betont werden, dass
die Prävalenz innerhalb Deutschlands sehr variabel ist.
In den USA gab es einen dramatischen Anstieg von MRSA, und zwar
nicht der üblichen 5 Subklone nosokomialer MRSAs, sondern
einen CA-MRSA
(community-acquired MRSA)-Anstieg (Folie 2).
Diese
neue Situation ist besonders auf molekularer Ebene interessant.
Innerhalb eines Zeitraums von wenigen Jahren kam es, an sehr
unterschiedlichen Orten, erstmals entdeckt bei Einwohnern Alaskas
und native Indians, zu einem Auftreten von CA-MRSA, zurückzuführen
auf das Mec-A-Gen, welches sich innerhalb einer chromosomalen
Kassette bei MRSA-Stämmen befindet.
In Deutschland beträgt der Anteil noch ca. 1%. Häufigster
Vertreter des CA-MRSA in den USA ist ST8, entsprechend PFGE-TYPE-USA300,
in Europa hingegen ST80. USA300 wird in Kontinentaleuropa nicht
durchkommen. Die Verbreitung von US300 hängt von unterschiedlichen
kulturellen Verhaltensweisen wie z.B. Austausch von Kleidung,
Waschen der Unterwäsche etc. ab – Verhaltensweisen,
die sich zwischen Kontinentaleuropa und USA signifikant unterscheiden.
Innerhalb von US300 trat erstmals in San Francisco in homosexuellen
Kreisen ein neuer Subklon auf, der mehr und mehr resistent wird.
Dieser nimmt R-Gene von Transposomen und Plasmiden auf und wird
dadurch immer fetter. Trotz der momentan starken Verbreitung
von USA300 scheint es, als könnte sich dieser Klon selbst
eliminieren.
Ein weiteres Problem mit MRSA besteht in Europa. Für den
bereits erwähnten Anstieg von MRSA in den Niederlanden
sind Schweinefarmen verantwortlich. Schweinefarmen in den Niederlanden
haben die Größe von Fabriken. Ein MSSA/MRSA-Klon
tritt dabei in Schweinen auf. Der MSSA nimmt verschiedene Resistenzgene
auf, dabei auch das Mec-A-Gen, das Strukturgen für Methicillin-Resistenz.
Dieser Klon, ST398, der ursprünglich wahrscheinlich ein
humaner Klon war und auf Schweine überging, wird nun wiederum
auf den Menschen übertragen und führt nun bereits
zu ersten
Ausbrüchen nosokomialer Infekte. Auch in Deutschland, nahe
der Grenze zu den Niederlanden, gibt es ST398 bereits in 18%
aller klinischen S. aureus-Isolate. Der Klon scheint
besonders promiskuitiv und suszeptibel für die Aufnahme
neuer DNA zu sein.
Es gibt noch weitere Bakterien-Klone, die auf ST398 im Schwein
treffen können. Einer davon ist ein Linezolidresistenter
Klon, eine sehr schwer zu erwerbende Resistenz. Hier kam es
jedoch zu einem Enzymmediierten Mechanismus aufgrund der Behandlung
von Schweinen mit Fofenicol. Das Resistenzgen liegt auf einem
mobilen Plasmid. In Deutschland gibt es davon bereits 3 Fälle.
Das
natürliche Habitat von S. aureus ist der Biofilm
(Folie 3), gruppiert an Oberflächen, vor allem an der Haut
bzw. in der Nasenschleimhaut, am Übergang zur Mukosa. Staphylokokken
mögen es, in Gesellschaft zu sein, in Zellvereinigungen
und immer an der Oberfläche.
In Deutschland wurde eine Multicenter-Studie durchgeführt,
bei der Nasenabstriche von Patienten in ganz Deutschland auf
klonale Identität getestet wurden. Das Resultat zeigte
80% Übereinstimmung der Klone. In einer weiteren Studie
am Prof.-Peters-Zentrum wurden ebenfalls Nasenabstriche von
Patienten entnommen, die möglicherweise eine S. aureus-Sepsis
entwickeln würden. Nach 7 Jahren hatten 14 dieser Patienten
eine Sepsis, auch hier mit 80%iger klonaler Identität,
gleichbedeutend mit endogener Herkunft der S. aureus-Sepsis.
In den Niederlanden wird eine große Follow up-Studie,
basierend auf den oben beschriebenen Resultaten, durchgeführt.
Für einige Wochen wurde in einer randomisierten Studie
bei Patienten mit geplantem Krankenhausaufenthalt, wie z.B.
elektiven chirurgischen Eingriffen, die nasale Kolonisation
(bei PCR-Positivität) mittels Mupirocin (lokal) eradiziert,
was in der Gruppe der mit Mupirocin Behandelten zu einer 60%igen
Reduktion von S. aureus-invasiven Infektionen führte.
Die Eradikation verringert demnach massiv das Risiko invasiver
Infektionen, aber es bilden sich Resistenzen. Die Resistenzrate
lag nach einem Jahr bei 4,1%, nach drei Jahren bei 7,7%. Wir
brauchen also dringend Konzepte zur Eradikation von S. aureus
in der Nase – Nisin oder Lysostaphin wären gute Möglichkeiten.
Ein weiteres Problem bei Infektionen mit S. aureus
findet man in seiner Fähigkeit, für ein und dieselbe
Aufgabe mehrere Strategien zu finden, wie z.B. die Adhäsion
an Oberflächen durch verschiedenste Oberflächenproteine
(Folie 4, 5).
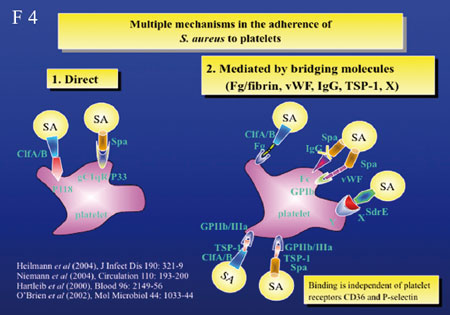 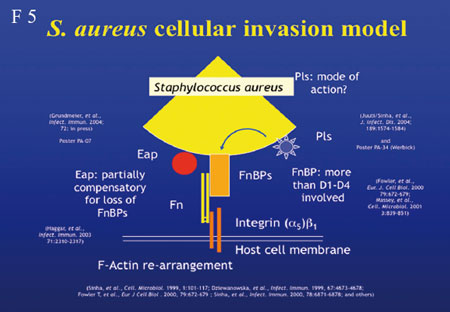
Zwei
Adhäsine, Eap und Emp sind wichtig für die Adhäsion
von S. aureus an menschliche Haut oder Knorpelgewebe,
KCl-Behandlung entfernt Emp und Eap von der Bakterienoberfläche
und verringert somit die Adhäsion an diese Gewebe. Bei
Präsenz zusätzlicher Adhäsine (FnBPs und Cna)
binden Eap und Emp auch an die extrazelluläre Matrix. Eap
besitzt außerdem “immune escape”-Fähigkeiten.
Diese Eigenheit von S. aureus, mit einem Protein zahlreiche
Funktionen zu erfüllen, macht ihn zu einem einzigartigen
Organismus.
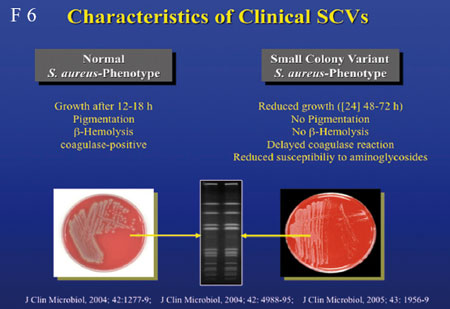
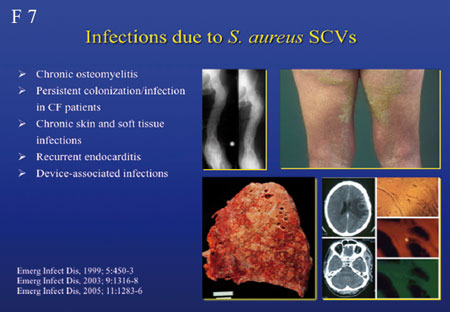
S. aureus gilt auch als intrazellulärer Erreger.
Bei Produktion hoher Konzentrationen von Toxinen, wie α-Toxin
wird dabei die Wirtszelle zerstört, bei niedrigen Konzentrationen
hingegen wird die Zelle in Apoptose getrieben; wird aber kein
Toxin gebildet, kann S. aureus in der Zelle dem Immunsystem
entgehen. Diesen Mechanismus nützt der SCV-Phänotyp
(Small colony variant), der mit chronisch verlaufenden S.
aureus-
Infektionen assoziiert ist (Folie 6, 7).
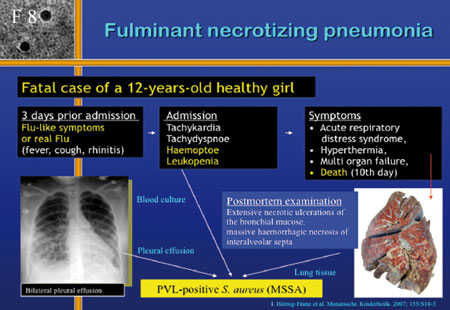
Zurück zu US300 und damit assoziierten Erkrankungen, allen
voran die fulminant nekrotisierende Pneumonie. Ein Fallbeispiel
(Folie 8): Ein 12-jähriges gesundes Mädchen wurde
mit Tachykardie, Tachydyspnoe, Hämoptoe und Leukopenie
aufgenommen. Drei Tage vor Aufnahme hatte das Mädchen Grippe-ähnliche
Symptome, 10 Tage nach Aufnahme verstarb sie. Die Obduktion
ergab extensive nekrotische Ulzerationen der bronchialen Mucosa
und massive hämorrhagische Nekrosen der interalveolären
Septen. Bei einer solchen fulminant verlaufenden Pneumonie mit
Leukopenie unter 1000/µl muss es sich um PVL(Panton-valentine
leukocytinetoxin)-positive Stämme handeln. PVL besteht
aus zwei Peptiden und zerstört neutrophile Granulozyten
durch Porenbildung.
|