Zur Epidemiologie
der Lyme-Borreliose
in Österreich & Borreliose-Update 2008 |
G. Stanek
Klinisches Institut für Hygiene und Medizinische Mikrobiologie,
Medizinische Universität Wien |
|
|
Epidemiologie
Brauchbare
Daten zur Epidemiologie der Lyme-Borreliose gibt es wenige und
dann nur von geografisch umschriebenen Daten-Erhebungen, deren
Ergebnisse obendrein schwer mit anderen vergleichbar sind. In
Österreich ist die Situation ebenso. Das komplexe Krankheitsbild
und die Schwierigkeit, aktuelle Erkrankungen mit typischen Symptomen
der Lyme-Borreliose von denjenigen Erkrankungen abzugrenzen,
die aufgrund serologischer Ergebnisse – positives IgM
und/oder IgG – fälschlich für eine Lyme-Borreliose
gehalten werden, beeinflussen das epidemiologische Bild.
Die
erste epidemiologische Bearbeitung von Daten aus ganz Österreich
stammt aus dem Jahr 1985 [STANEK, FLAMM1985]. Es war der Beginn
des Studiums der Lyme-Borreliose, deren Erreger erst 3 Jahre
zuvor entdeckt worden war. Damals wurden etwa 386(!) Patientendaten
verwertet. Am häufigsten – und daran hat sich nichts
geändert – wurden Erythema migrans-Fälle diagnostiziert
(70,1%), gefolgt von Meningopolyneuritis (20,2%), Acrodermatitis
chronica atrophicans (7,1%), Arthritis (1,8%) und Borrelien-Lymphozytom
(0,8%). Die Verteilung dieser Fälle auf die Bundesländer
zeigt deutlich, dass damals die Fallzahlen sehr von den bereits
mitbestimmten Aspekten der Borreliose vertrauten Kollegen begünstigt
waren. Der Anteil von Patienten mit Erythema migrans und Meningopolyneuritis
wurde in Wien, Niederösterreich, Burgenland, Oberösterreich,
Steiermark, Kärnten, Salzburg, Tirol und Vorarlberg in
88%, 72%, 94%, 80%, 71%, 75%, 31%, 35% und 100% beziehungsweise
in 12%, 28%, 6%, 20%, 29%, 25%, 69%, 65% und 0% gesehen. Die
saisonale Verteilung der Diagnosen zeigte für Erythema
migrans auch damals schon ganz deutlich einen Gipfel im Juli
und für Meningopolyneuritis einen breiteren Gipfel im August
und September. Damals zeigte sich auch, dass die Borrelien-Serologie
bei der Diagnose des Erythema migrans keine Hilfe ist (IgM-
und IgG-positive in 32,2%), während man bei Meningopolyneuritis
in 98,7% überwiegend IgG- und bei Acrodermatitis chronica
atrophicans nur noch IgG-Antikörper in100% gefunden hatte.
Eine
Studie zur Epidemiologie von durch Zecken vermittelten neurologischen
Erkrankungen in Tirol [SCHMUTZHARD et al. 1985] zeigte, dass
es damals bereits autochthone FSME-Fälle in Tirol gab,
dass aber durch Borrelia burgdorferi sensu lato verursachte
neurologische Manifestationen annähernd 6x häufiger
waren.
Im
Laufe der Jahre hat sich durch das uns zugängliche Datenmaterial
zeigen lassen, dass mit steigender Zahl von erfassten Borrelien-Infektionen
der Anteil an Erythema migrans-Fällen immer größer
und der von neurologischen Manifestationen der Lyme-Borreliose
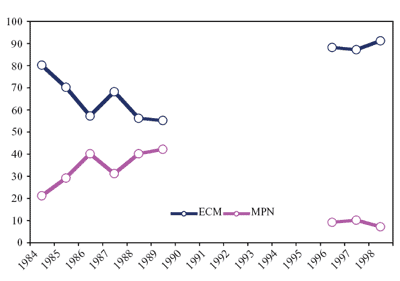
immer kleiner wurde (Abbildung 1).
Abbildung
1: Anteil Erythema migrans (EM)- und Meningopolyneuritis
(MPN)-Fälle an den klinischen Manifestationen der Lyme-Borreliose
in Österreich aus den Jahren 1984–1989 und 1996–1998
|
| Fragebogen-Erhebung
im Rahmen eines EU-Projekts
Im
Rahmen des EU-Projekts BOVAC-512598 wurden bestimmte Ärztegruppen
aus dem niedergelassenen Bereich sowie die Leiter von Abteilungen
für Dermatologie, Neurologie, Pädiatrie, Innere Medizin/Rheumatologie
und Orthopädie der österreichischen Krankenhäuser
eingeladen, Zahlen über ihre klinisch diagnostizierten
Fälle an Lyme-Borreliose über ein Fragebogensystem
mitzuteilen.
Das Ziel der Aktion war, mittels Fragebogen Angaben über
die Häufigkeit der klinischen Diagnose Lyme-Borreliose
in Erfahrung zu bringen, die von Allgemeinmedizinern und FachärztInnen
für Dermatologie, Innere Medizin, Kinder- und Jugendheilkunde,
Neurologie und Orthopädie im Jahr 2006 gestellt worden
sind.
Bekanntmachung
des Fragebogens
Der
Fragebogen „ABC (Austrian Borreliosis Count) EU-Projekt
BOVAC-512598“ wurde mit einem Einladungsbrief bekannt
gemacht, der über die „Österreichische Ärztezentrale“
an 10107 Adressen von Allgemeinmedizinern (66%), Dermatologen
(5%), Internisten (15%), Neurologen (4%), Kinderärzten
(5%), Orthopäden (5%) und an die Primarärzte der jeweiligen
Spezialgebiete in den Krankenhäusern versandt und auch
online verfügbar gemacht worden ist.
Ergebnisse
Von
10107 angeschriebenen Ärzten haben nur 194 den Fragebogen
verwendet (1,9%). Allerdings lieferten diese Ärzte Daten
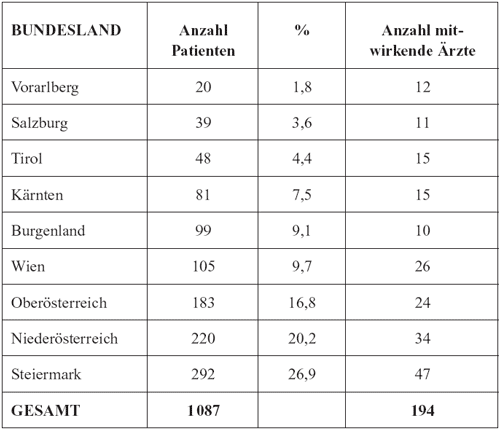
von 1087 Patienten. Tabelle 1 zeigt die Unterschiede in der
Anzahl teilnehmender Ärzte und der Anzahl von Patienten,
von denen Daten mitgeteilt worden waren. Wenn man die Anzahl
der mitgeteilten Fälle mit der Anzahl der Ärzte pro
Bundesland vergleicht, dann kann man daraus schließen,
dass Ärzte in Vorarlberg jeweils nur zwei Lyme-Borreliose-Fälle
im Jahr diagnostizieren, in Tirol drei, in Salzburg und Wien
jeweils vier, in Kärnten fünf, in der Steiermark und
Niederösterreich jeweils sechs, in Oberösterreich
acht und im Burgenland neun. Auf Basis dieser Ergebnisse kann
man annehmen, dass durchschnittlich jeweils fünf Lyme-Borreliose-Patienten
von einem Arzt pro Jahr gesehen werden, was eine minimale Inzidenz
von über 50000 Neuerkrankungen an Lyme-Borreliose pro Jahr
in Österreich annehmen lässt. Da diese Zahlen nur
spekulativ sind, muss der Anzahl der Ärzte, die geantwortet
haben, diejenige Zahl an Ärzten gegenübergestellt
werden, die nicht geantwortet haben.
Tabelle
1: Anzahl Ärzte und von diesen mitgeteilte Anzahl
von Lyme-Borreliose-Fällen aus den verschiedenen österreichischen
Bundesländern
Die
Patienten waren zu 51,2% weiblich, mit einem medianen Alter
von 54 Jahren (1 bis 92 Jahre), und zu 48,5% männlich,
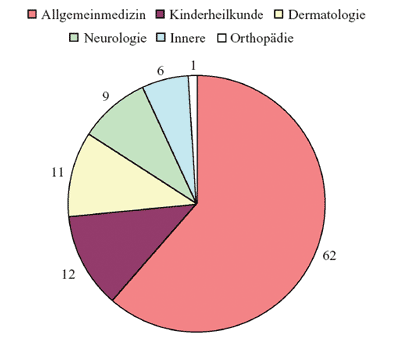
mit einem medianen Alter von 47 Jahren (1 bis 82 Jahre). 62%
dieser Patienten wurden von Allgemeinmedizinern gesehen, 12%
von Kinderärzten, 11% von Dermatologen, 9% von Neurologen,
6% von Internisten und 1% von Orthopäden (Abbildung 2).
Abbildung
2: Mitgeteilte Diagnosen von verschiedenen Fachärztegruppen
(%)
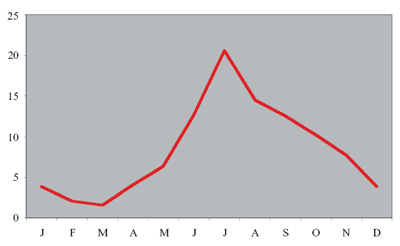
Die
Diagnosen wurden vorwiegend im Juli gestellt, was auf eine hohe
Zeckenaktivität in den vorausgegangenen Monaten schließen
lässt (Abbildung 3).
Abbildung
3: Monate des Jahres 2006, in denen Fälle von
Lyme-Borreliose in Österreich diagnostiziert worden sind
Unter
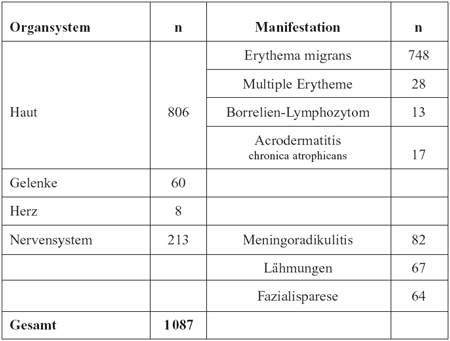
den klinischen Erscheinungen wurden Hautinfektionen am häufigsten
diagnostiziert, gefolgt von neurologischen, Gelenks- und Herz-Erkrankungen.
Von den 806 Patienten mit Borrelien-Hautinfektionen hatten 748
ein Erythema migrans, 28 multiple Erythemata migrantia, 13 ein
Borrelien-Lymphozytom und 17 Acrodermatitis chronica atrophicans.
Beiden neurologischen Manifestationen waren es 82 Fälle
von Meningoradikulitis, 64 Fazialisparesen und andere Lokalisationen
von Lähmungen in 67 Fällen (Tabelle 2).
Tabelle
2: Mitgeteilte Manifestationen der Lyme-Borreliose
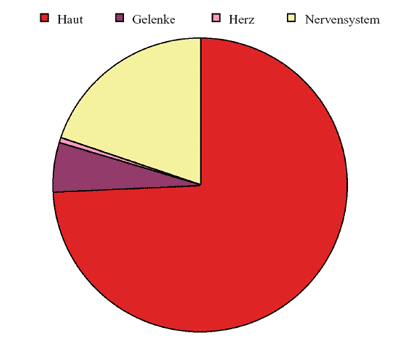
Abbildung
4 zeigt die klinische Dominanz der Hautmanifestationen der Lyme-Borreliose.
Abbildung
4: Anteil der verschiedenen Organmanifestationen
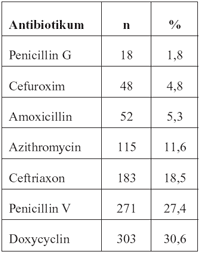
Daten
zur antibiotischen Behandlung der Erkrankungen wurden für
990 Patienten mitgeteilt (Tabelle 3). Unter den am häufigsten
verwendeten Antibiotika waren Doxycyclin und Penicillin V, welche
beide oral verabreicht werden und am häufigsten zur Behandlung
der Hautmanifestation Erythema migrans verordnet worden sind.
Ceftriaxon wird intravenös verabreicht und wurde fast ausschließlich
zur Behandlung der Neuroborreliose eingesetzt. Azithromycin
wurde ebenfalls zur Behandlung von Haut-Manifestationen eingesetzt.
Tabelle
3: Zur Behandlung der Lyme-Borreliose verwendete Antibiotika
für Patienten des mitgeteilten Kollektivs aus dem Jahr
2006
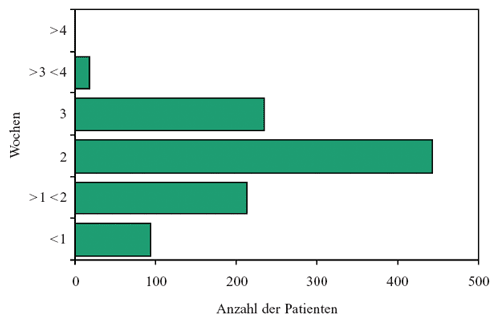
Die
Mehrzahl der Patienten wurde ambulant (81,6%) und nur 18,4%
wurden im Krankenhaus behandelt. Die Dauer der Behandlung variierte,
doch die meisten Patienten wurden über zwei Wochen behandelt
(Abbildung 5).
Abbildung
5: Dauer der antibiotischen Behandlung
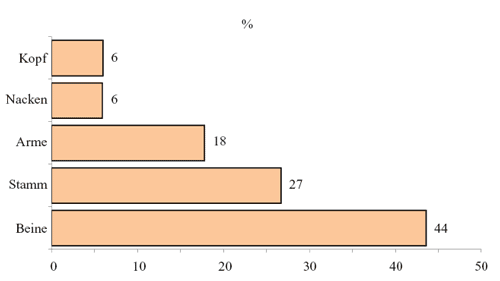
Schließlich
lagen Angaben von 544 Patienten (50%) über die Lokalisation
eines Zeckenstichs vor, welche sich am häufigsten auf den
Beinen fand (43,6%), dann am Stamm, einschließlich der
Abdominal-, Genito-, Inquino-, Gluteal-Region (26,7%). Arme
und Hände (17,8%), Nacken (5,9%) und Kopf (6,1%) waren
am seltensten von Zeckenstichen betroffen (Abbildung 6).
Abbildung
6: Lokalisation von Zeckenstichen am Körper; Verteilung
in %
Konklusion
Aus
den angeführten Ergebnissen epidemiologischer Aufarbeitung
von erhobenen Daten lässt sich leicht erkennen, dass manche
Kenngrößen der Lyme-Borreliose konstant bleiben –
wie etwa die Häufung der Diagnose „Erythema migrans“
im Juli – während andere stark schwanken, wie zum
Beispiel der Anteil an „Lyme-Neuroborreliose“. Dieser
hat sich gegen Ende der 1980er Jahre von 20 auf über 40%
hinaufbewegt, während er Ende der 1990er Jahre auf unter
10% abgefallen war. Die Ergebnisse der BOVAC-Umfrage geben 20%
an. Dabei muss man prospektiv der Frage nachgehen, ob hier nicht
überwiegend periphere Neuropathien anderer Genese mit positiver
Borrelien-Serologie und einem graduellen Ansprechen auf Antibiotika-Therapie
als Neuroborreliose interpretiert worden sind. Objektive Zahlen
sind somit spärlich vorhanden, einerseits, weil keine Meldepflicht
besteht und weil die häufigste Manifestation, das Erythema
migrans, primär klinisch diagnostiziert wird und somit
eine spezifische Bestätigung der Diagnose, falls es sich
nicht um ein typisches Erythema migrans handelt, das vom erfahrenen
Arzt mit Sicherheit identifiziert werden kann, ohne Anzüchtung
von Borrelien aus einer Biopsie der betroffenen Haut nicht möglich
ist.
Damit
fehlt das objektive Instrument. Objektive Zahlen können
am ehesten für die Neuroborreliose erstellt werden, weil
Patienten mit dieser Symptomatik gewöhnlich hospitalisiert
und die klinische Diagnose darüber hinaus durch spezifische
Laboratoriums-Ergebnisse bestätigt wird. Eine neuerliche,
nun prospektive Fragebogenaktion soll hier mehr Klarheit schaffen.
Die
Abschätzung der Inzidenz der Lyme-Borreliose beruht heute
auf folgenden Stützpfeilern: Jährlich werden etwa
16% der Bevölkerung von Zecken gestochen; 4 – 8%
der von Zecken gestochenen Personen erkranken manifest. Damit
ergibt sich für Österreich mit einer Bevölkerung
von ca. 8 Millionen Menschen eine geschätzte Inzidenz von
im Minimum 0,6% und im Maximum von 1,0%, also eine geschätzte
Zahl von 51000 bis 80000 Neuerkrankungen an Lyme-Borreliose
pro Jahr.
|
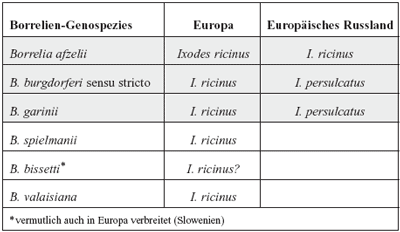
Erreger
der Lyme-Borreliose Zu
den Erregern der Lyme-Borreliose in Europa gehören die
Genospezies Borrelia afzelii, Borrelia garinii
und Borrelia burgdorferi sensu stricto und Borrelia
spielmanii, wobei letztere zwei Genospezies in Europa am
seltensten aus Untersuchungsmaterial von Patienten isoliert
worden sind (Tabelle 4, Abbildung 7).
Tabelle
4: Krankheitserreger der Lyme-Borreliose, Borrelia
burgdorferi sensu lato-Genospezies, in Europa und dem europäischen
Russland, sowie ihre Vektoren
Abbildung
7: Borrelien-Kultur, Dunkelfeldmikroskopie x 1200
Reservoire
Zahlreiche
frei lebende Säuger und Vögel wurden als Wirte von
Borrelia burgdorferi sensu lato identifiziert, wobei
Vögel eine Wirts-Spezifität für Borrelia
garinii (OspA-Serotypen 3, 5, 6, 7) und für Borrelia
valaisiana und Nager eine für Borrelia garinii
(OspA-Serotyp 4), Borrelia afzelii und Borrelia
bissettii zeigen [KURTENBACH et al. 2002]. An die 300 verschiedenen
Wirbeltierarten einschließlich Säuger, Vögel
und Reptilien werden in Europa von Ixodes ricinus als
Blutwirte genützt. Etwa vierzig verschiedene Wirbeltierarten
wurden bisher als kompetente Reservoire für Borrelia
burgdorferi sensu lato identifiziert [GERN & HUMAIR,
2002]. Dazu gehören die Mäuse Apodemus flavicollis,
Apodemus sylvaticus und Apodemus agrestis,
die Feldmaus Clethrionomys glareolus und Microtus
agrestis sowie die Rattenarten Rattus rattus und
Rattus norvegicus. Auch Siebenschläfer und verschiedene
Eichhörnchenarten wurden als Reservoir-kompetent identifiziert.
Lagomorphen wie der Feldhase (Lepus europaeus) und
das europäische Kaninchen (Oryctolagus cuniculus)
und auch Vögel, die man zunächst ungeeignet für
Borrelien-Reservoire gehalten hat, sind Reservoir-kompetente
Tiere, wie zum Beispiel die am Boden Futter suchende Amsel (Turdus
merula). Aus Reservoirtieren vom nordöstlichen Niederösterreich
wurden überwiegend Borrelia afzelii-Stämme
isoliert, gefolgt von Borrelia burgdorferi sensu stricto
und Borrelia garinii [KHANAKAH et al. 2006].
|
| Ixodes
ricinus, Überträger von Borrelia burgdorferi sensu
lato in Europa Borrelia
burgdorferi sensu lato vollzieht seinen Infektionszyklus
in einem Naturherd, in dem Schildzecken des Ixodes ricinus-Komplex
als Vektoren und eine große Zahl von Wirbeltieren als
Borrelien-Reservoire fungieren. Von den zahlreichen Ixodes-Zecken
spielen in Europa nur die Arten Ixodes ricinus (Europa,
europäisches Russland und der Nordrand Afrikas) und Ixodes
persulcatus (europäisches Russland und Asien) als
Überträger der „Lyme-Borrelien“ eine Rolle.
Schildzecken saugen nur einmal in jedem Entwicklungsstadium
(Larve, Nymphe, adulte männliche und weibliche Zecke) und
nehmen dabei im Lauf von Tagen eine relativ große Blutmenge
von derselben Körperstelle des Wirts auf. Die europäische
Zecke Ixodes ricinus, der sogenannte Holzbock, klettert
in seinen verschiedenen Entwicklungsstadien auf die bodennahe
Vegetation und lässt sich von vorbeikommenden Blut-Wirten
abstreifen. Auf dem Wirt sucht die Zecke eine geeignete Hautstelle
für die Blutmahlzeit, schlitzt die Haut mit den skalpellartigen
Mundwerkzeugen (Chelizeren) auf, führt den gezahnten Rüssel
(Hypostom) in die Wunde, welcher zusammen mit dem sogenannten
Zement, der von den Speicheldrüsen sezerniert wird, die
Zecke fest an ihrem Platz verankert. Dort haftet die Zecke für
einige Tage fest, Larven 2–3 Tage, Nymphen 4–5 Tage
und adulte weibliche Zecken 7–9 Tage. In dieser Zeit wächst
sowohl der Darm als auch die Haut aktiv, um die enormen Blutmengen
zu bewältigen, welche in den letzten 24 Stunden der Blutmahlzeit
aufgenommen werden [GRAY 2002]. Die adulte männliche Zecke,
deren Rücken zur Gänze von einem Chitinschild bedeckt
ist, nimmt selbst nur sehr selten eine und dann eine sehr kleine
Blutmahlzeit, befruchtet das Weibchen gewöhnlich bei ihrer
Blutmahlzeit und stirbt dann ab. Zecken stechen Blutgefäße
nicht direkt an, sondern bilden durch Sekretion vasoaktiver
Mediatoren und Immunmodulatoren einen sogenannten "feeding
pool", in dem das Blut flüssig bleibt und Gegenreaktionen
des Wirts unterdrückt werden. Die Blutmahlzeit wird durch
Wasser-Extraktion konzentriert, das Wasser durch die Speicheldrüsen
der Zecke in den Wirt sezerniert, mit dem auch die Krankheitserreger
in den Blutwirt gelangen.
Wenn die Zecke vollgesogen ist, zieht sie das Hypostom zurück,
fällt vom Wirtstier ab, beginnt die Blutmahlzeit zu verdauen
und sich ins nächste Stadium zu entwickeln. Die Verdauung
erfolgt durch Pinozytose (Mikrophagozytose) und Endozytose der
Blutbestandteile durch die Darmwandzellen. Danach folgt eine
intrazelluläre Verdauung anstelle einer intraluminalen,
wie sie bei den meisten anderen hämatophagen Arthropoden
üblich ist. Die Verdauung und die anschließende Verwandlung
in das nächste Entwicklungsstadium gehen langsam vor sich.
Die Entwicklung kann in den gemäßigten Klimazonen
einige Monate dauern. Nach der Metamorphose folgt eine Ruhephase,
bis die ungesogene Zecke schließlich auf die Vegetation
klettert und einem neuen Blutwirt auflauert.
Bei Ixodes ricinus kann zwischen den Blutmahlzeiten
ein ganzes Jahr vergehen. Krankheitserreger werden bei der Blutmahlzeit
an verschiedenen Wirtstieren aufgenommen. Das Überleben
von aufgenommenen Mikroorganismen wird durch den von Verdauungs-Enzymen
freien Darm von Schildzecken begünstigt. Das erklärt
auch, warum Zecken eine größere Vielfalt von Mikroorganismen
beherbergen und übertragen können als andere Arthropoden.
Die Lyme-Borrelien bleiben im Darm und wandern erst bei der
Blutmahlzeit des nächsten Entwicklungsstadiums der Zecke
in die Speicheldrüsen. Sie benötigen eine bestimmte
Zeit zur Aktivierung, welche gewöhnlich durch Temperaturerhöhung
bei der Blutmahlzeit erreicht wird. Da jedes Zecken-Entwicklungsstadium
nur einmal eine Blutmahlzeit benötigt, werden die Infektionserreger
durch ein Entwicklungsstadium aufgenommen (Larve oder Nymphe)
und durch das nächste übertragen (Nymphe oder adulte
weibliche Zecke); man nennt dies die transstadiale Übertragung.
In Ixodes ricinus-Zecken aus Österreich, die 2005
gesammelt worden sind, wurde eine Prävalenz von Borrelia
garinii in allen Entwicklungsstadien der Zecke [BLASCHITZ
et al. 2007] festgestellt.
Infektionszyklus
Lyme-Borrelien befinden sich bei ungesogenen Zecken primär
im Mitteldarm und haften unter Expression des Oberflächenproteins
A (OspA) am Darmepithel. Bei der nächsten Blutmahlzeit
wird die Expression von OspA zugunsten von OspC unterdrückt,
um den Darm verlassen und über die Speicheldrüsen,
wo die Borrelien mit Speichelproteinen umhüllt werden,
in den Blutwirt zu gelangen [ROSA 2005]. Im Säugerwirt
werden weitere Proteine exprimiert, um der unspezifischen und
spezifischen Abwehr zu entgehen [STEVENSON et al. 2006]. Reservoir-kompetente
Wirbeltiere sind von den anderen wichtigen Blutwirten dieser
Schildzecken zu unterscheiden. Im Experiment sind humanpathogene
Borrelien-Stämme gegenüber dem Complement von verschiedenen
Nagern wie Wald- und Gelbhalsmaus, Feld- und Wühlmaus sowie
Hamster und Eichhörnchen resistent, jedoch empfindlich
gegenüber dem Complement größerer Tiere wie
Schafe, Schweine, Pferde, Rinder und Hirsche. Letzteres führt
bereits unspezifisch zur Borreliolyse [KURTENBACH et al. 2002].
|
| Lyme-Borreliose
Die
Lyme-Borreliose ist die häufigste durch Zecken vermittelte
bakterielle Infektionskrankheit in der nördlichen Hemisphäre.
Es handelt sich um eine Multisystem-Erkrankung, die Haut, Nervensystem,
Muskel- und Skelettsystem und andere Organe wie Herz, Augen,
Nieren und Leber befällt. Die Krankheitserreger werden,
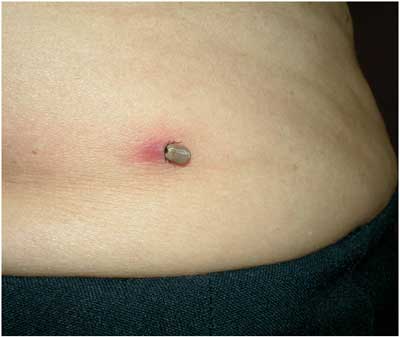
nach dem Stand des Wissens, ausschließlich durch Ixodes-Zecken
übertragen. Nach einem Zeckenstich (Abbildung 8), der nur
etwa von der Hälfte der Betroffenen wahrgenommen wird,
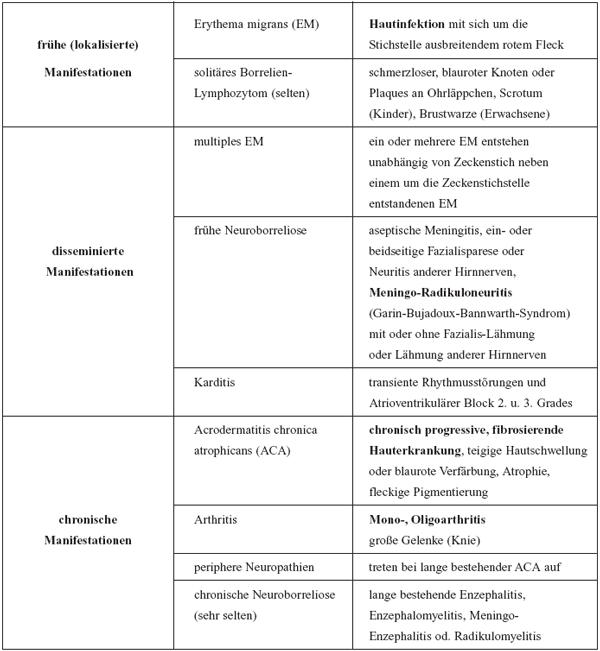
erkranken rund 4–8% mit klinischen Erscheinungen. Tabelle
5 gibt eine Zusammenstellung verschiedener klinischer Manifestationen,
die als frühe lokalisierte, frühe disseminierte und
chronisch persistierende oder progrediente Infektionen unterschieden
werden. Disseminierung und Organmanifestation sind an Eigenschaften
der jeweiligen Borrelienstämme sowie der Wirtsreaktion
gebunden, die bisher nur ansatzweise verstanden werden.
Abbildung
8: Adulte weibliche Zecke nahezu vollgesogen
Tabelle
5: Manifestationen der Lyme-Borreliose
Erythema
migrans
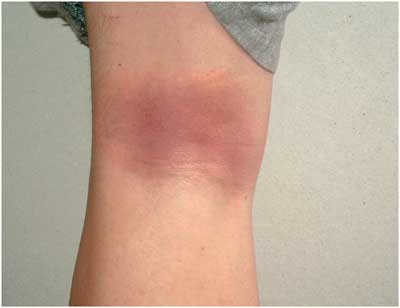
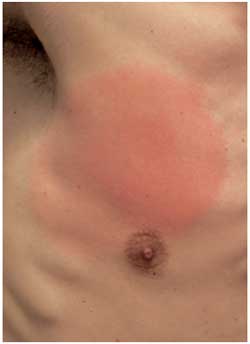
Die
am häufigsten diagnostizierte Manifestation ist das Erythema
migrans (EM), das bei über 85% der Patienten die einzige
klinische Erscheinung bleibt. In Europa wird das EM ganz überwiegend
von Borrelia afzelii verursacht. Die Hautinfektion
entwickelt sich nach einer Inkubationszeit von wenigen Tagen
bis über einen Monat nach dem Zeckenstich. Sie ist durch
einen sich zentrifugal um die Stichstelle ausbreitenden roten
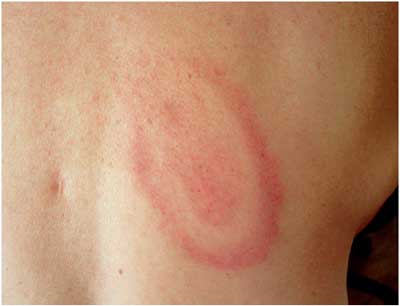
Fleck charakterisiert (Abbildungen 9, 10). Die Kokardenform
ist ebenfalls nicht ungewöhnlich (Abbildung 11). Eine zentrale
Abblassung wird bei zunehmender Ausdehnung des EM beobachtet
(Abbildung 12a, 12b). Allerdings kann diese auch nach einer
monatelangen „Migration“ des EM fehlen, wie die
Abbildung 13 zeigt, wo sich ein EM nach Zeckenstich auf der
Brust entwickelt und nach monatelangem Verlauf ohne Begleiterscheinungen
bis auf die Schultern ausgedehnt hat. Multiple EM (MEM) entstehen
infolge einer hämatogenen Verbreitung der Borrelien, vom
ursprünglichen Erythem ausgehend. Sie treten neben dem
ersten EM, das um die Zeckenstichstelle entstanden ist, unabhängig
von der Zeckenstichstelle auf verschiedenen Hautstellen auf.
MEM werden in Europa viel seltener als in den USA beobachtet.
Das typische EM ist die einzige Manifestation der Lyme-Borreliose,
die einwandfrei klinisch diagnostiziert werden kann.
Im Zweifelsfall wird die Diagnose durch die Anzüchtung
von Borrelia burgdorferi sensu lato und/oder den Nachweis
von Borrelien-Nukleinsäure-Abschnitten mittels Nukleinsäure-Amplifikationsmethoden
in Hautproben bestätigt. Serologische Untersuchungen zum
Nachweis der aktuellen Infektion sind in der Diagnose des Erythema
migrans nicht zielführend, weder eine diagnostische Hilfe
noch ein Indikator für Therapieerfolg oder Therapieversagen
[STANEK et al.1999; STANEK & STRLE 2003].
| Abbildung
9:
Erythema (chronicum) migrans in der Kniekehle
|
Abbildung
10: Erythema migrans auf der Brust,
Ausdehnung 4 Wochen nach Zeckenstich
|
Abbildung
11: Erythema migrans, kokardenförmig, auf dem
Rücken
| Abbildung
12a: Erythema (chronicum) migrans auf dem Unterschenkel,
zentrale Abblassung einige Tage nach Behandlungsbeginn
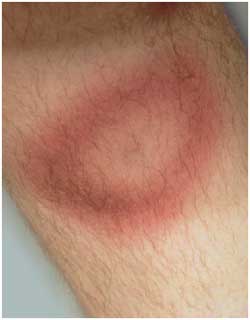
|
Abbildung
12b: Zentrale Abblassung bei zunehmender Ausdehnung
des Erythema (chronicum) migrans
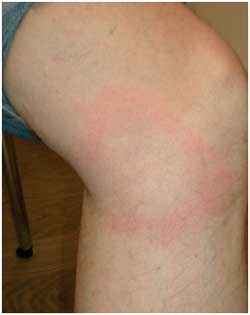
|
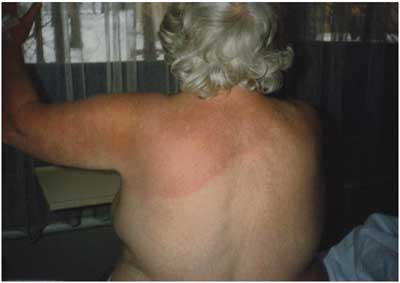
Abbildung
13: Erythema migrans nach Zeckenstich auf der Brust;
nach monatelangem Verlauf dehnt sich das Erythem von der Brust
über die Schulter bis auf den Rücken aus.
Borrelien-Lymphozytom
Das
Borrelien-Lymphozytom, das viel seltener als das EM beobachtet
wird, imponiert als schmerzloser, blauroter Knoten oder Plaque,
der sich bei Kindern gewöhnlich am Ohrläppchen, am
Ohrrand oder am Skrotum, bei Erwachsenen an der Brustwarze befindet
(Abbildungen 14, 15, 16). Ein vorausgegangenes oder vorhandenes
Erythema migrans und der histologische Nachweis eines B-Zell-Pseudolymphoms
unterstützen die Diagnose. Selten gelingt der Beweis der
Borrelien-Infektion durch Anzüchtung von Borrelia burgdorferi
sensu lato [STRLE et al. 1992] oder Borrelien-Nukleinsäure-Nachweis
aus Hautbiopsien.
Abbildung
14: Borrelien-Lymphozytom am Ohrläppchen.
Die blaurote Schwellung kann unbehandelt über Wochen
bestehen bleiben.
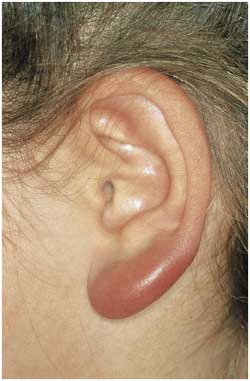
|
Abbildung
15:
Borrelien-Lymphozytom am Ohrläppchen
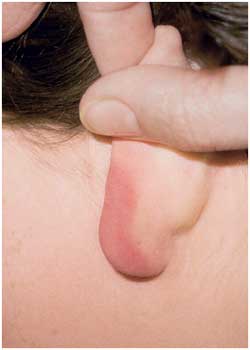
|
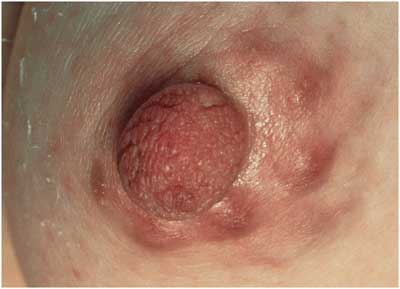
Abbildung
16: Borrelien-Lymphozytom an der Brustwarze
Acrodermatitis
chronica atrophicans (ACA)
Bei
der ACA handelt es sich um eine chronisch-progressive, fibrosierende
Hauterkrankung, die in Europa die häufigste Form einer
chronischen Lyme-Borreliose darstellt. Der Erreger ist ganz
überwiegend Borrelia afzelii. ACA tritt gewöhnlich
auf den Streckseiten der Extremitäten auf (Abbildung 17),
zuerst als teigige Haut-Schwellung oder blaurote Verfärbung,
später gefolgt von Atrophie, welche die Haut sehr zart
und durchscheinend macht, gefältelt wie Zigarettenpapier
(Abbildung 18). Die Venen treten deutlich hervor, eine fleckige
Pigmentierung tritt auf. Über Knochenvorsprüngen sind
Verdickungen und Knotenbildungen möglich. Eine im Jahr
1905 angefertigte Moulage eines ganzen Beines einer Patientin
mit ACA belegt die schon über mehr als ein Jahrhundert
in unseren Breiten vorkommende „chronisch idiopathische
Hautatrophie“ (Abbildung 19). Bei lange bestehender ACA
tritt bei einem Großteil der Fälle eine periphere
Neuropathie auf [KRISTOFERITSCH et al. 1988] als Folge einer
kontinuierlich bestehenden Infektion. Borrelien wurden aus mehr
als 20 Jahre bestehenden ACA-Hautläsionen isoliert. Gewöhnlich
findet man bei ACA-Patienten hohe Serumkonzentrationen von IgG-Antikörpern
gegen Borrelia burgdorferi sensu lato. Das histologische
Bild einer intensiven lymphozytären Infiltration und die
Anzüchtung sowie der Nachweis von Borrelia burgdorferi
sensu lato-Nukleinsäure in Hautproben bestätigen die
klinische Diagnose.
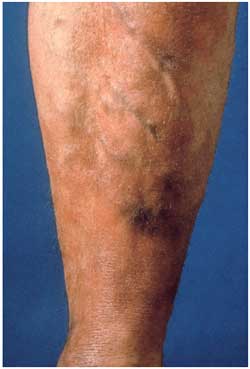
Abbildung
17: Acrodermatitis chronica atrophicans am Unterschenkel.
Die Haut ist fleckig pigmentiert undverdünnt, Venen treten
hervor, infolge der Atrophie aller Hautschichten ist die Haut
leicht zu verletzen
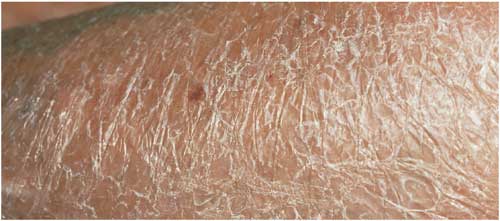
Abbildung
18: Acrodermatitis chronica atrophicans; atrophe, zigarettenpapierartig
verdünnte Haut
Abbildung
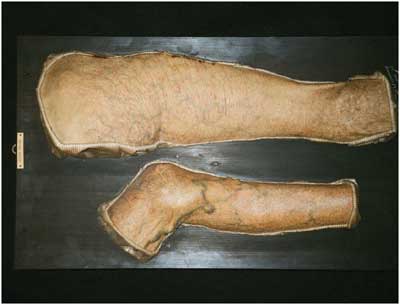
19: Im Jahr 1905 fertiggestellte Moulage eines ganzen
Beines einer Patientin mit „Atrophia cutis idiopathica
diffusa“, heute Acrodermatitis chronica atrophicans genannt.
Die Veröffentlichung dieser Abbildung erfolgt mit freundlicher
Genehmigung der Direktion des pathologisch-anatomischen Bundesmuseums,
Frau Direktor Dr. Beatrix Patzak, 1090 Wien.
Neuroborreliose
Die
Neuroborreliose ist nach dem EM die häufigste Manifestation
der Lyme-Borreliose in Europa. Mit einer Inkubationszeit von
durchschnittlich 4 (Kinder) bis 7 (Erwachsene) Wochen manifestiert
sie sich als milde aseptische Meningitis, isolierte einseitige
oder manchmal beidseitige Fazialisparese oder
als Neuritis anderer Hirnnerven beziehungsweise bei Erwachsenen
gewöhnlich als schmerzhafte Meningo-Radikuloneuritis
(Garin-Bujadoux-Bannwarth-Syndrom) mit oder ohne Fazialis-Lähmung
oder Lähmung anderer Hirnnerven.
Das diagnostische Spektrum umfasst Radikuloneuritis, Meningoradikulitis,
kraniale Hirnnervenneuritis, Meningitis, Meningoenzephalitis,
Radikulomyelitis, Enzephalitis und Enzephalomyelitis. Die Radikulitis-Symptome
entwickeln sich durchschnittlich sieben Wochen nach dem Zeckenstich
oder nach einem EM. Dabei treten zuerst Schmerzen auf, mit wechselnder
Lokalisation und Zunahme der Schmerzintensität in der Nacht.
Die Schmerzen werden als brennend, bohrend, beißend oder
reißend erlebt und sprechen nur wenig auf Analgetika in
üblicher Dosierung an. Bei drei von vier dieser Patienten
entwickeln sich nach einer bis vier Wochen neurologische Ausfälle,
Lähmungen häufiger als Sensibilitätsstörungen.
Die Lähmungen sind oft asymmetrisch verteilt, wobei die
Körperregion, von der die Zecke entfernt oder auf der das
EM lokalisiert war, häufig deutlicher betroffen ist als
die Gegenseite.
Da die Radikulitis im Gegensatz zu der seltenen Polyneuritis
prompt auf eine Behandlung mit Antibiotika anspricht, wird eine
primär durch die Erreger hervorgerufene Entzündungsreaktion
angenommen. Beim Großteil der Patienten mit Bannwarth-Syndrom
kommt es zu Hirnnervenausfällen. Alle Hirnnerven können
betroffen sein, mit Ausnahme des Riechnerven. Bei Hirnnervenbeteiligung
ist ganz überwiegend der Nervus facialis betroffen, wobei
ein beidseitiger Befall nicht selten ist. Unabhängig von
der Schwere der Fazialisparese ist die Prognose sehr gut. In
den meisten Fällen kommt es innerhalb von 1–2 Monaten
zu einer vollständigen Rückbildung. Defektheilungen
werden bei etwa 5% der Patienten beobachtet. Eine Beteiligung
des zentralen Nervensystems wird im Rahmen einer Neuroborreliose
sehr selten festgestellt; sie verläuft meistens chronisch.
Die häufigste Manifestation ist eine Myelitis mit spastisch-ataktischem
Gang und Blasenstörung. Die Symptomatik kann sich über
Tage oder mehrere Monate entwickeln. Bei 2/3 der Patienten kommt
es zu einer schweren Tetra- oder Paraparese. Bei mehr als der
Hälfte der Patienten mit Myelitis finden sich zusätzliche
Zeichen einer Enzephalitis und bei etwa der Hälfte eine
Hirnnervenbeteiligung.
Eine periphere Neuropathie wird bei europäischen Patienten
meist in Verbindung mit einer ACA gesehen. Die Beschwerden äußern
sich in distal verteilten Parästhesien. Die wenigen histologischen
Untersuchungen zeigten Perivaskulitis und thrombosierte epineurale
Blutgefäße. Im Liquor cerebrospinalis findet sich
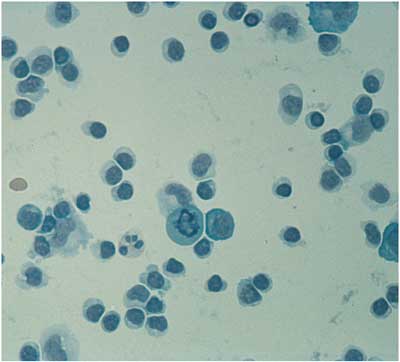
eine lymphozytäre Pleozytose (Abbildung 20). Intrathekal
gebildete spezifische Antikörper lassen sich bei Erwachsenen
meist regelmäßig nachweisen. Bei Kindern mit isolierter
Fazialisparese sowie sehr früh nach Krankheitsbeginn kann
die Liquorpleozytose fehlen [MILLNER et al. 1989]. Früh
nach Krankheitsbeginn und bei geringer Liquor-Zellzahl gelingt
auch die Anzüchtung der Borrelien aus dem Liquor, der Erreger
ist überwiegend Borrelia garinii.
Abbildung
20: Lympho-plasmazelluläre Pleozytose im Liquor
cerebrospinalis. Dieses Liquorzellbild ist charakteristisch
für eine meist durch Borrelia garinii verursachte
Meningo-Radikuloneuritis Garin-Bujadoux-Bannwarth.
Lyme-Arthritis
Die
Lyme-Arthritis, die in Europa viel seltener diagnostiziert wird
als in Nordamerika, manifestiert sich meist als intermittierende
oder chronische Mono- oder Oligoarthritis der großen Gelenke
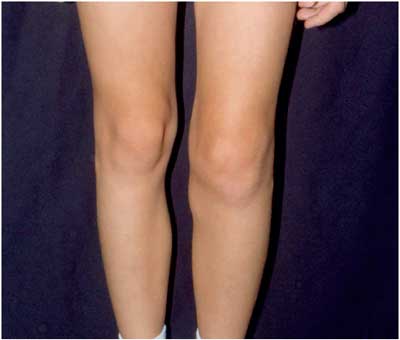
(Abbildung 21), die selten mit Erosionen von Knorpel und Knochen
verbunden sein kann. Das Knie ist am häufigsten betroffen.
Der Nachweis von Borrelien-DNA in Synovialflüssigkeit und
Synoviabiopsien sowie der seltene kulturelle Borrelien-Nachweis
aus diesen Proben weisen auf eine direkte Infektion des Gelenks
hin.
Die Gelenksentzündung(en) schwinden nach einigen Jahren
spontan [HERZER 1993]. Bei manchen Patienten mit einer sogenannten
Behandlungs-resistenten Arthritis scheint eine genetische Prädisposition
zur Arthritis zu bestehen, denn sie findet sich viel häufiger
bei Personen mit einem HLA-DR2- oder DR4-Phänotyp, was
auf einen Immunogenitäts-Faktor in der Pathogenese hinweist.
Bei amerikanischen Patienten ist in etwa der Hälfte der
Fälle die Blutsenkungsgeschwindigkeit leicht erhöht,
bei Leukozytose und/oder einem erhöhten Serum-IgM. Das
CRP ist gewöhnlich im Normalbereich. Kryoglobuline und
zirkulierende Immunkomplexe können vorliegen. Die meisten
Patienten haben keine Rheumafaktoren, keine antinukleären
Antikörper. Polymorphkernige Leukozyten überwiegen
in der Synovialflüssigkeit, die Zellzahl bewegt sich zwischen
0,5 und 110 x 109 pro L. Die Diagnose Lyme-Arthritis basiert
auf der Anamnese, dem klinischen Erscheinungsbild, dem Ausschluss
anderer Arthritis-Ursachen und dem Nachweis von Serum-IgG-Antikörpern
gegen Borrelien. Die Anzüchtung von Borrelien aus der Synovialflüssigkeit
gelingt nur sehr selten [MARLOVITS et al. 2004]. Hingegen ist
der Nachweis von Borrelien-DNA in der Synovialflüssigkeit
oder in der Synovia mittels PCR sensitiver. Differentialdiagnostisch
gleicht die Lyme-Arthritis bei Kindern am ehesten einer oligoartikulären
juvenilen Arthritis und bei Erwachsenen einer reaktiven Arthritis.
Abbildung
21: Lyme-Arthritis des linken Kniegelenkes. Man erkennt
auch eine Wadenschwellung infolge einer Baker-Zyste.
(Die Abbildung wurde von Prof. Dr. Peter Herzer, München,
in dankenswerter Weise zur Verfügung gestellt.)
Lyme-Karditis
Infolge
einer Infektion des Reizleitungssystems des Herzens äußert
sich die Lyme-Karditis in transienten Rhythmusstörungen
und Atrioventrikulärem Block zweiten und dritten Grades.
Die Isolierung von Borrelia burgdorferi sensu stricto
aus Herzmuskelproben eines Patienten mit lange bestehender dilatativer
Kardiomyopathie [STANEK et al. 1990] gaben Anlass zu Vermutungen
über einen ätiologischen Zusammenhang. Allerdings
fehlen bisher kontrollierte Studien aus Europa, deren Ergebnisse
Licht in diese Fragestellung werfen könnten. Insgesamt
ist die spezifische Diagnose der Lyme-Karditis durch den Mangel
an Möglichkeiten für den direkten Erregernachweis
sehr schwierig.
Unspezifische
Symptome
Unspezifische
Symptome, die einige Patienten nach Behandlung einer frühen
oder disseminierten Form der Lyme-Borreliose berichten, nämlich
Beschwerden wie Krankheitsgefühl, Müdigkeit, Unruhe,
psychische Veränderungen, Depression, Kopf-, Muskel- und
Gelenksschmerzen, lassen sich mangels kontrollierter Studien
in Europa nur schwer in einen ursächlichen Zusammenhang
mit einer Infektion durch Borrelia burgdorferi sensu
lato bringen. Das ist deshalb besonders schwierig, weil gelegentlich
auftretende muskulo-skeletale, neuro-kognitive oder Müdigkeits-Symptome
sich nicht von denen unterscheiden, die durch andere Infektionen
oder belastende physische oder emotionale Ereignisse ausgelöst
werden können.
|
| Diagnostik
In
vitro-Tests zum Nachweis einer Infektion mit Borrelia
burgdorferi sensu lato sollten dazu dienen, die klinische
Diagnose des Arztes zu untermauern, entscheiden helfen, ob der
Patient an Lyme-Borreliose erkrank tist oder nicht.
Die
Anzüchtung von Borrelia burgdorferi sensu lato
aus Haut, Blut, Liquor cerebrospinalis, Synovia oder anderem
Gewebe eines Patienten wäre der sicherste Nachweis einer
aktiven Borrelien-Infektion, der „Gold Standard“.
Allerdings wird diese aufwendige Nachweismethode gewöhnlich
nur von den Referenz-Laboratorien beherrscht.
Die
„Borrelien-Serologie“, gemeint ist der Nachweis
von Antikörpern der IgG- und IgM-Klasse gegen Borrelia
burgdorferi sensu lato, hat sich wegen ihrer Praktikabilität
als die übliche Diagnosehilfe bei Verdacht auf Lyme-Borreliose
durchgesetzt; bedauerlicher Weise, möchte man sagen. Wenn
auch Sensitivität und Spezifität gemessen an speziellen
„streng negativen“ Kontrollseren nahe an 100% herankommen,
so ergeben sich bei der Analyse einer einzelnen Probe erhebliche
Probleme. Das Ergebnis kann keine Auskunft über eine vergangene
oder aktuelle Infektion geben. Die „Hintergrund-Aktivität“
variiert, je nachdem, ob die gesunde Bevölkerung in endemischen
Regionen lebt oder bestimmten Berufsgruppen wie Jägern
angehört. Bei Jägern finden sich zum Teil sehr hohe
Seroprävalenzen [CETIN et al.2006].
Das
Problem vergrößert sich, wenn Patienten selbst einen
„Lyme-Test“ wegen eigener unspezifischer Beschwerden
durchführen lassen. Schon ein einzelnes grenzwertiges oder
positives IgM-Ergebnis wird als Zeichen einer frischen Infektion
gewertet. Dazu kommt noch, dass selbst die modernen serologischen
Subunit-Assays, die rekombinante oder gereinigte Proteine verwenden,
zum Teil einen sehr hohen Grad an falsch positiven Ergebnissen
produzieren. Das Zwei-Test-Prinzip wurde eingeführt, um
die Spezifität des Ergebnisses mit dem sogenannten „Suchtest“,
einem IFA oder Sonikat-ELISA, mittels Western- oder Immunoblot
zu prüfen. Dieses Prinzip könnte sich heute bei einer
hohen Spezifität der „modernen“ Borrelien-ELISAs
erübrigen. Inzwischen stellte sich heraus, dass nicht nur
die modernen ELISAs sondern auch rekombinante Westernblots zum
Teil sehr hohe Sensitivitäten aufweisen, sodass dem Ausmaß
an falsch positiven oder nicht interpretierbaren Testergebnissen
selbst mit dem Westernblot / Immunoblot kein Einhalt geboten
werden kann.
Der
wertvollste Beitrag der Serologie wird durch den Nachweis intrathekaler,
also im Liquorraum gebildeter Antikörper, erbracht. Hiezu
ist die Bestimmung von Gesamtimmunglobulin G und Albumin in
Liquor- und Serumprobe Voraussetzung.
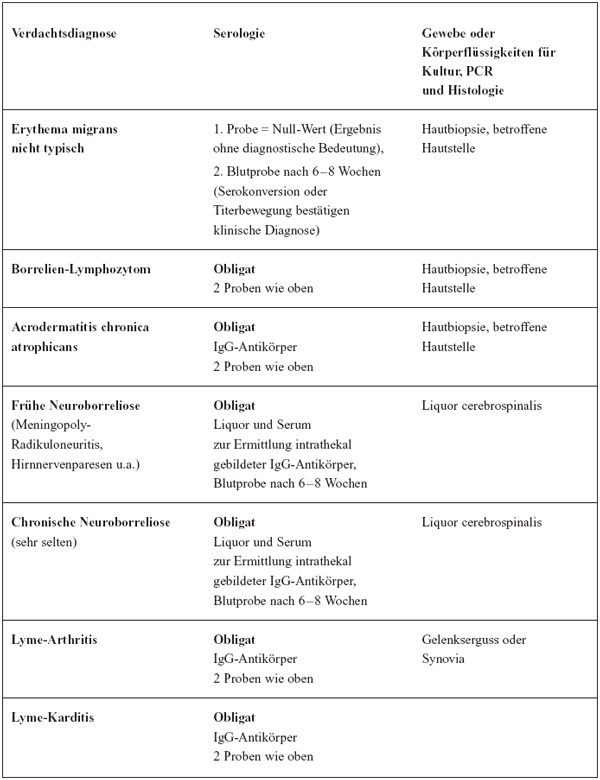
Tabelle
6 gibt eine Empfehlung für die Auswahl des geeigneten Untersuchungsmaterials,
wobei die Kombination von indirektem (Serologie) und direktem
Erregernachweis (Kultur und PCR) wo möglich gemeinsam genutzt
werden sollte.
Tabelle
6: Indikationen für die Einsendung von Untersuchungsmaterial
zur Labordiagnose der Lyme-Borreliose
|
| Therapie
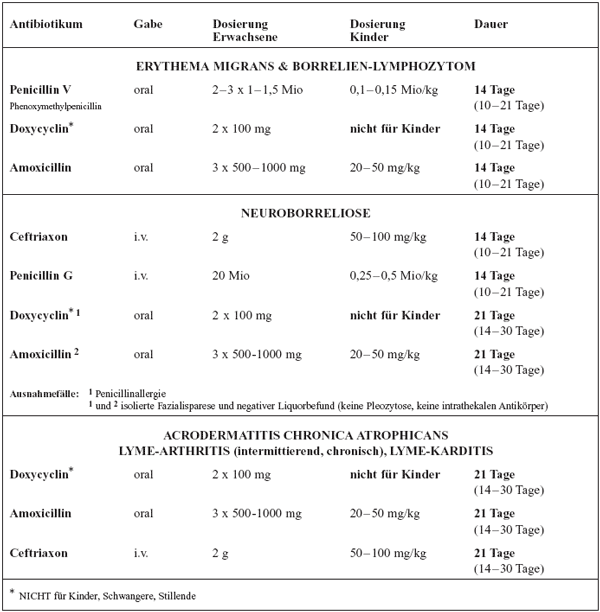
In
Tabelle 7 sind die Antibiotika nach den Indikationen zur Behandlung
der Lyme-Borreliose zusammengestellt. Für die Behandlung
des typischen, häufigen Erythema migrans hat sich Phenoxymethylpenicillin
(PenicillinV) als Mittel der Wahl etabliert; Penicillin V ist
sowohl zur Behandlung von Kindern und Erwachsenen, Schwangeren
und Stillenden geeignet und schränkt die Sonnen-Exposition
nicht ein.
Tabelle
7: Antibiotika für die Behandlung der Lyme-Borreliose
|
| Prophylaxe
Wenn
man von Zecken bewohnte Gebiete meidet, dann könnte man
der Infektionsgefahr entgehen. Für Österreich würde
das bedeuten, dass man zumindest als Städter auf einen
Ausflug ins Grüne oder auf einen Badegenuss in natürlichen
Gewässern verzichten müsste. Aber selbst das wäre
nicht ausreichend, weil infizierte Zecken auch in Grünanlagen
der Städte existieren. Eventuell könnte man sich dem
Risiko einer Zeckenexposition aussetzen, wenn man Repellentien
verwendet. Diese haben den Nachteil, dass sie oft nur auf der
Kleidung anzuwenden sind oder bei wiederholter Anwendung Hautreaktionen
hervorrufen können. Außerdem sind Repellentien keine
Lösung für Landbewohner, die in der entsprechenden
Jahreszeit täglich Zecken-exponiert sind.
Die
antibiotische Behandlung eines Zeckenstichs, wie sie in den
USA unter bestimmten Voraussetzungen empfohlen wird [SHAPIRO
et al. 1992] ist abzulehnen. Einmal ist die Manifestationsquote
zu gering – etwa 95% der Personen mit Zeckenstich würden
unnötig mit Antibiotika belastet – und andererseits
würde die ungezielte Verwendung von Antibiotika eventuell
zur Resistenzentwicklung bei Bakterien der eigenen Flora führen.
Schließlich schützt die adäquate Behandlung
einer frühen Manifestation der Lyme-Borreliose in der Regel
vor weiteren Manifestationen der komplexen Erkrankung.
Nach
einer wirksamen und sicheren Impfung gegen Lyme-Borreliose wird
häufig gefragt. Bekanntlich gab es bereits einen derartigen
Impfstoff für die Anwendung in den USA. Das Konzept der
Impfung stützte sich auf die Tatsache, dass Borrelia
burgdorferi sensu lato in der Zecke mittels OspA an das
Epithel des Mitteldarms anheftet und dass diese Adhärenz
mit spezifischen OspA-Antikörpern gehemmt wird. Rekombinante
OspA-Impfstoffe mit dem OspA-Serotyp 1 (OspA von Borrelia
burgdorferi sensu stricto) hatten sich in der klinischen
Prüfung in den Phase-III-Studien als wirksam erwiesen [SIGAL
et al. 1998, STEERE et al. 1998]. Schließlich wurde der
Impfstoff der Firma Glaxo Smith Kline, der aus rekombinantem
OspA plus Aluminium Adjuvans bestand, auf den Markt gebracht
und Anfang 2002 wieder vom Markt genommen. Das geschah deshalb,
weil unglücklicherweise in einer kurz nach Freigabe der
Impfung veröffentlichten experimentellen Studie die Meinung
vertreten wurde, dass eine Behandlungsresistente Lyme-Arthritis
mit einer Immunreaktion gegen OspA von Borrelia burgdorferi
sensu stricto verbunden wäre [GROSS et al. 1998]. Diese
Meinung hat sich inzwischen als falsch erwiesen. Das Konzept
der OspA-Impfung ist jedenfalls sehr originell, weil dabei nicht
das Angehen der Infektion nach Eindringen der Krankheitserreger
verhindert werden soll, sondern die Übertragung der Krankheitserreger
selbst durch deren Zerstörung in der Zecke unterbunden
werden soll.
|
Literatur
| Blaschitz
M, Narodoslavsky-Gföller M, Kanzler M, Walochnik J
& Stanek G (2007): Borrelia burgdorferi sensulato genospecies
in questing Ixodes ricinus ticks in Austria.Int J Med Microbiol
2007 [Epub ahead of print]. |
| Cetin
E, Sotoudeh M, Auer H & Stanek G (2006): Paradigm Burgenland:
risk of Borrelia burgdorferi sensu lato infection indicated
by variable seroprevalence rates in hunters. Wien Klin Wochenschr
118:677-681. |
| Gern
L & Humair P-F (2002): Ecology of Borrelia burgorferi
sensu lato in Europe. In Gray JS, Kahl O, Lane RS &
Stanek G (Eds): Lyme Borreliosis Biology, Epidemiology and
Control. CABI publishing UK 2002; pp 149-174. |
| Gray
J (2002): Biology of Ixodes species ticks in relation to
tick-borne zoonoses.Wien Klin Wochenschr 114:473-478. |
| Gross
DM, Forsthuber T, Tary-Lehmann M, Etling C, Ito K, Nagy
ZA, Field JA, Steere AC, Huber BT (1998): Identification
of LFA-1 as a candidate autoantigen in treatment-resistant
Lyme arthritis. Science 281:703-706. |
| Herzer
P (1993): Rheumatic manifestations in Lyme borreliosis.
Clin Dermatol 11:401-406. |
| Khanakah
G, Kocianová E, Vyrosteková V, Rehácek
J, Kundi M & Stanek G (2006): Seasonal variations in
detecting Borrelia burgdorferi sensu lato in rodents from
northeastern Austria. Wien. Klin. Wochenschr 118:754-758. |
| Kristoferitsch
W, Sluga E, Graf M, Partsch H, Neumann R, Stanek G &
Budka H(1988): Neuropathy associated with acrodermatitis
chronica atrophicans: clinical and morphological findings.
Ann. New York Acad Scie 539:35-45. |
| Kurtenbach
K, Schäfer SM, de Michelis S, Etti S & Sewell HS
(2002): Borrelia burgorferi sensu lato in vertebrate hosts.
In Gray JS, Kahl O, Lane RS & Stanek G (Eds): Lyme Borreliosis
Biology, Epidemiology and Control. CABI publishing UK 2002;
pp117-148. |
| Marlovits
S, Khanakah G, Striessnig G, Vecsei V & Stanek G (2004):
Emergence of Lyme arthritis after autologous chondrocyte
transplantation. Arthritis Rheum 50:259-264. |
| Millner
M, Schimek MG, Spork D, Schnizer M & Stanek G (1989):
Lyme borreliosis in children. A controlled clinical study
based on ELISA values. Eur J Pediatr 148:527-530. |
| Rosa
P (2005): Lyme disease agent borrows a practical coat. Nat
Med 11:831-832. |
| Schmutzhard
E, Dierich MP, Gerstenbrand F, Kunz Ch, Pohl P, Stanek G,
Wimmer PP: Zur Epidemiologie der durch Zecken übertragenen
neurologischen Krankheiten in Tirol. Neuropsychiatrie 1985;
1:18-23. |
| Shapiro
ED, Gerber MA, Holabird NB, Berg AT, Feder HM Jr., Bell
GL, Rys PN, Persing DH (1992): A controlled trial of antimicrobial
prophylaxis for Lyme disease after deer-tick bites. N Engl
J Med 327:1769-1773. |
| Sigal
LH, Zahradnik JM, Lavin P, Patella SJ, Bryant G, Haselby
R, Hilton E, Kunkel M, Adler-Klein D, Doherty T, Evans J,
Molloy PJ, Seidner AL, Sabetta JR, Simon HJ, Klempner MS,
Mays J, Marks D & Malawista SE (1998): A vaccine consisting
of recombinant Borrelia burgdorferi outer-surface protein
A to prevent Lyme disease. Recombinant Outer-Surface Protein
A Lyme Disease Vaccine Study Consortium. N Engl J Med 339:216-222. |
| Stanek
G, Flamm H (1985): Epidemiologie von Borrelia-Infektionen
in Österreich. Österreichische Ärztezeitung
40:19-22. |
| Stanek
G, Klein J, Bittner R & Glogar D (1990): Isolation of
Borrelia burgdorferi from the myocardium of a patient with
long-standing cardiomyopathy. N Engl J Med 322:249-252. |
| Stanek
G, O´Connel S, Cimmino M, Aberer E, Kristoferitsch
W, Granstrom M, Guy E & Gray J (1996): European Union
concerted action on the risk assessment of Lyme borreliosis:
Clinical case definitions. Wien Klin Wochenschr 108:741-747. |
| Stanek
G & Strle F (2003): Lyme Borreliosis. Lancet 362:1639-1647. |
| Steere
AC, Sikand VK, Meurice F, Parenti DL, Fikrig E, Schoen RT,
Nowakowski J, Schmid CH, Laukamp S, Buscarino C & Krause
DS (1998): Vaccination against Lyme disease with recombinant
Borrelia burgdorferi outer-surface lipoprotein A with adjuvant.
Lyme Disease Vaccine Study Group. N Engl J Med 339:209-215. |
| Stevenson
B, von Lackum K, Riley SP, Cooley AE, Woodman ME & Bykowski
T(2006): Evolving models of Lyme disease spirochete gene
regulation. Wien Klin Wochenschr 118:643-652. |
| Strle
F, Pleterski-Rigler D, Stanek G, Pejovnik-Pustinek A, Ruzic
E & Cimperman J (1992): Solitary borrelial lymphocytoma:
report of 36 cases. Infection 20:201-206. |
Anschrift
des Verfassers:
Univ.-Prof. Dr. med. Gerold Stanek
Medizinische Universität Wien
Klinisches Institut für Hygiene und Medizinische Mikrobiologie
A-1095 Wien, Kinderspitalgasse 15
E-Mail: gerold.stanek@meduniwien.ac.at
|
|
|