| Chinolone in
der Veterinärmedizin |
O. Robak, W. Graninger
Univ.-Klinik für Innere Medizin I, Klin. Abt. für
Infektionen und Tropenmedizin, Medizinische Universität
Wien |
|
|
|
Zusammenfassung
In
der Veterinärmedizin werden zunehmend Antibiotika verwendet.
Gleichzeitig treten Resistenzen gegen verschiedene Klassen von
Antibiotika auf. Chinolone sind bakterizide antimikrobielle
Wirkstoffe, die die bakterielle Gyrase bei Gram-positiven und
Gram-negativen Erregern hemmen. Die häufigsten Gyrasehemmer
sind Fluorchinolone wie Danofloxacin, Difloxacin, Enrofloxacin,
Marbofloxacin, Orbifloxacin und Sarafloxacin. Der exzessive
Gebrauch in Prophylaxe und Therapie hat zu einem starken Anstieg
resistenter Erreger geführt. Eine Prophylaxe mit Chinolonen
sollte vermieden werden. Eine falsche Verwendung wird zu resistenten
Erregern führen, wie das heute schon bei Campylobacter,
E. coli und Salmonellen der Fall ist.
|
|
Summary
The
use of antibiotics in veterinary medicine has increased over
the past few years. Simultaneously, more and more organisms
have gained resistance against different subgroups of antimicrobial
substances. Quinolones are antimicrobials with a strong bactericidal
effect and are often used inveterinary medicine. Common fluoroquinolones
in veterinary medicine are danofloxacin, difloxacin, enrofloxacin,
marbofloxacin, orbifloxacin, and sarafloxacin. Excessive use
of these substances, not only as therapeutic agent but also
as prophylaxis, caused a strong increase of infections with
bacterial strains resistant against fluoroquinolones. Aquaculture
often used antibiotics. The use of antimicrobial substances
should be appropriate regarding dosage, pharmaceutical form
and duration. Quinolones should not be used as prophylaxis.
Otherwise resistant species will soon become a problem even
in human medicine with bacteria that cannot be treated with
quinolones, like Campylobacter spp., E. coli
and Salmonella spp.
|
Einleitung
Der
Gebrauch von antimikrobiell wirksamen Substanzen in der Veterinärmedizin
ist in den letzten Jahren stark angestiegen. Aufgrund ihrer
bakteriziden Aktivität sind Chinolone weit verbreitet zur
Bekämpfung von Infektionen durch sowohl Gram-positive als
auch Gram-negative Erreger.
Chinolone interagieren mit der DNA-Gyrase (entspricht der Topoisomerase
II der Eukaryonten) sowie in geringerem Ausmaß mit der
Topoisomerase IV, die beide nur bei Bakterien vorkommen. Die
DNA-Gyrase ist für das Super-Coiling verantwortlich und
fügt geschnittene DNA-Stränge wieder zusammen. Dieser
Effekt wird durch Gyrase-Hemmer wirkungsvoll unterbunden. Außerdem
können Chinolone gut durch die Blut-Hirn-Schranke diffundieren
und eignen sich somit auch zur Behandlung von z.B. intrazerebralen
Abszessen. Gyrase-Hemmer können verschiedenen chemischen
Gruppen angehören:
•
Chinolone (inkl. Fluorchinolone)
•
Cinnoline
• Naphthyridine
• Pyridopyrimidine
Die
wichtigsten Vertreter sind die Chinolone, deren erster Vertreter
die Nalidixinsäure war. Ausgehend davon wurde eine Vielzahl
von Substanzen entwickelt, die sowohl in der Veterinärmedizin
als auch in der Humanmedizin Bedeutung haben. Hier soll speziell
auf die Substanzen eingegangen werden, die in der Veterinärmedizin
verwendet werden. |
| Danofloxacin
Danofloxacin
(Advocin®, Advocid®) ist durch seine große therapeutische
Breite geeignet für eine Vielzahl von Keimen. Es ist ein
Fluorochinolon der 3. Generation mit bakterizider Wirkung, welches
sowohl oral als auch parenteral verwendet werden kann. Der Wirkeintritt
ist relativ schnell, die Verteilungshalbwertszeit bei i.v-Gabe
beträgt 11-17 Min. Es weist bei subkutaner und intramuskulärer
Verabreichung eine vergleichbare Wirkung auf wie nach einer
i.v. Applikation. Bei per-os-Gabe werden 80-90% resorbiert.
Danofloxacin wird bis zu 40% über die Niere ausgeschieden,
der Rest über die Galle. Es wird vor allem bei Infektionen
der Atemwege eingesetzt. Bei Schweinen und Rindern wirkt es
gegen Infektionen mit Pasteurella haemolytica, Pasteurella
multocida, Haemophilus somnus, Actinobacillus
pyogenes und Mycoplasma, weiters gegen Infektionen
des Gastrointestinaltrakts mit Salmonella typhimurium.
Die Dosis beträgt bei i.m.-Gabe 1-5 mg/kg KG über
3-5 Tage. Bei Geflügel verwendet man es gegen Gastroenteritiden
mit E. coli, Mycoplasma gallisepticum und
Pasteurella multocida. Hier beträgt die orale
Dosierung 3-6 mg/kg Lebendgewicht über 3 Tage. |
| Difloxacin
Difloxacin (Dicural®, Vetequinon®) ist wirksam gegen
Gram-negative, jedoch auch gegen einige Gram-positive Bakterien,
Kokken und Mycoplasmen. Gegen Anaerobier ist es nicht oder nur
schwach wirksam. Als Fluorchinolon ist seine bakterizide Wirkung
dosisabhängig. Es hat eine gute enterale Bioverfügbarkeit
und eignet sich somit zur bevorzugten p.o.-Gabe. Ein schmackhafter
Überzug bewirkt eine gute Akzeptanz bei Hunden. Difloxacin
sollte nicht gleichzeitig mit Antazida oder NSAR verwendet werden.
Es wird mit einer Eliminationshalbwertszeit von ~6Std. bevorzugt
(~90%) über die Niere ausgeschieden. Es erreicht daher
im Urin hohe Konzentrationen. Bei wiederholter Gabe kann es
aufgrund der langen Halbwertszeit zur Akkumulation kommen. Aufgrund
seiner Pharmakokinetik wird es vor allem bei Harnwegsinfekten
(E. coli, Staphylokokken und Proteus)
eingesetzt. Ausserdem kann es bei Infektionen im Bereich des
Atemtrakts sowie Weichteilinfektionen (Staph. intermedius,
Klebsiella pneumoniae, Proteus spp., weiters
Pseudomonas spp.) verwendet werden. Die empfohlene
Tagesdosis liegt bei 5 mg/kg KG, die Behandlung sollte einmal
täglich über mind. 5 bis max. 10 Tage fortgeführt
werden.
|
| Enrofloxacin
Enrofloxacin
(Baytril®) ist das am weitesten verbreitete Chinolon in
der Veterinärmedizin und wird am häufigsten verwendet.
Es ist ein Fluorchinolon der 2. Generation, das ausschließlich
in der Veterinärmedizin Verwendung findet. Die verbreitetsten
pathogenen Keime haben MHK-Werte (mininale Hemm-Konzentration)
zwischen 0,01-2 µg/ml. Neben Enrofloxacin ist auch sein
Metabolit Ciprofloxacin, welcher in der Humanmedizin große
Bedeutung hat, bakterizid wirksam. Die orale Bioverfügbarkeit
ist stark variabel von Art zu Art. Es penetriert gut in die
Gewebe und reichert sich in Galle, Leber, Niere, Lunge und den
Fortpflanzungsorganen an. Neben einer p.o.-Gabe kann Enrofloxacin
auch i.v. und i.m. verabreicht werden. Es wird über die
Leber und die Nieren ausgeschieden, bei einer beeinträchtigten
Nierenfunktion sollte daher auch eine verlängerte Wirkdauer
beachtet werden und die Gabe wenn möglich vermieden werden.
Die Halbwertszeit für Enrofloxacin beträgt ca. 2-7
Stunden. Die Standarddosis liegt bei 5 mg/kgKG für 3-5
Tage, bei schweren Infektionen (Sepsis) und für spezielle
Indikationen (orthopädische Infektionen) bis zu 15 mg/kg
KG für bis zu 10 Tage. Als Hauptindikation gelten Infektionen
im Urogenital- sowie Gastrointestinaltrakt, weiters systemische
und Gelenksinfektionen.
|
| Marbofloxacin
Marbofloxacin
(Marbocyl®, Zenequin®) wirkt gegen Gram-positive und
Gram-negative Keime, jedoch vor allem gegen Enterobacteriaceae,
Pasteurella, Pseudomonas und Staphylokokken.
Die höchsten Spiegel findet man in Lunge, Leber und Niere.
Es wird über die Niere und den Kot ausgeschieden, davon
bis zu 40% unverändert. Die Halbwertszeit im Plasma ist
mit 9,5 Std. bei Marbofloxacin größer als bei Enrofloxacin
oder Difloxacin. Daher ist auch die Gefahr der Akkumulation
größer und sollte entsprechend bei Niereninsuffizienz
beachtet werden. Die empfohlene Dosierung für Vögel
liegt bei 10 mg/kg KG pro Tag, bei Schweinen und Rindern bei
2 mg/kg KG pro Tag. Neben der s.c.- sowie i.v.-Gabe bietet sich
die per-os-Gabe an, die orale Bioverfügbarkeit liegt bei
annähernd 90%. Indiziert ist Marbofloxacin bei Infektionen
des Respirationstrakts (Pasteurella multocida, P.
haemolytica und Mycoplasma bovis) sowie bei der
akuten Mastitis (E. coli) bei Rind und Kalb. Beim Schwein
eignet es sich zur Anwendung beim Milchfieber sowie ebenfalls
bei Atemwegsinfektionen (Actinobacillus pleuro-pneumoniae,
Pasteurella multocida und M. hypopneumoniae).
|
| Orbifloxacin
Orbifloxacin
(Orbax®, Victas®) ist ein Fluorchinolon-Präparat,
welches speziell für die Bedürfnisse der Veterinärmedizin
entwickelt wurde. Auch sein Wirkungsspektrum umfasst Gram-positive
und Gram-negative Erreger und wirkt nur schwach gegen Anaerobier.
Es sind Resistenzen bei Pseudomonas- sowie bei vielen
Enterococcus-Stämmen aufgetreten. Die orale Bioverfügbarkeit
liegt bei annähernd 100%, nach 45 Minuten ist die komplette
Dosis resorbiert. Dies sollte daher auch die bevorzugte Gabe
sein. Orbifloxacin wird zu 50% unverändert über die
Nieren ausgeschieden. Wie die meisten Chinolone wird Orbifloxacin
bei Infektionen des Respirations-, des Urogenitaltraktes und
bei Hauterkrankungen (v. a. bei Hund und Katze) verwendet. Die
orale Dosis liegt bei 2,5-7,5 mg/kgKG täglich für
Hunde und Katzen, bei Pferden sollten 5 mg/kg KG verwendet werden.
Schweine erhalten i.m. 5 mg/kg KG.
|
| Sarafloxacin
Sarafloxacin
(Floxasol®, Saraflox®, Sarafin®) ist ein ebenfalls
antimikrobiell wirksamer Metabolit von Difloxacin (Dicural®,
Vetequinon®). Es wirkt vor allem gegen Aeromonas salmonicida,
Vibrio salmonicida, Vibrio anguillarum und
Yersinia ruckeri. Die MHK liegt zw. 0,0025 und 0,3
µg/ml. Die Halbwertszeit liegt bei ~30 Std., selbst nach
14 Tagen sind beim Aal noch Reste in Leber und Niere nachweisbar.
Sarafloxacin wird vor allem bei Infektionskrankheiten von Zuchtfischen
gegen empfindliche Keime verwendet. Die empfohlene Dosis beträgt
15 mg/kg Lebendgewicht.
|
| Oxolinsäure
Oxolinsäure
ist ein älteres Chinolon, das mittlerweile durch potentere
Wirkstoffe vielfach abgelöst wurde. Bei Geflügel wird
es eingesetzt gegen Kolibazillose, verursacht durch Oxolinsäure-empfindliche
Organismen (aviäre pathogene E. coli- APEC). Bei
Fischen verwendet man es bei Infektionen, verursacht durch Gram-negative
Keime. Die übliche Dosierung für Geflügel beträgt
8 g pro100 kg Lebendgewicht und Tag, eingemischt in die notwendige
Futtermenge über 5 Tage. Die Dosierung für Fische
beträgt 5 g pro 100 kg Lebendgewicht und Tag, während
5 bis 6 Tagen eingemischt in das Futter. |
| Diskussion
Der
exzessive Gebrauch von Gyrase-Hemmern, sei es aus Vorsicht oder
Unüberlegtheit, hat in letzter Zeit zum Auftreten vieler
resistenter Stämme geführt. Ca. 50% sind medizinisch
nicht gerechtfertigt. Diese werden zunehmend zum Problem nicht
nur in der Veterinärmedizin, sondern auch in der Humanmedizin.
Als Beispiel sei hier die Verwendung von antimikrobiell wirksamen
Substanzen in der industriellen Meeresfrüchte-Produktion
genannt: Besonders bei Shrimps-und Lachs-Aquakulturen werden
regelmäßig vorbeugend (also nicht therapeutisch)
Antibiotika (u.a. auch Chinolone) verwendet, um den Befall mit
Salmonellen, Vibrio spp. und Listerien einzudämmen.
Viele von ihnen wurden nie für ihre Eignung in Aquakulturen
getestet. Die Folge war einerseits, dass in Shrimps vermehrt
resistente Bakterienstämme, v.a. Salmonellen, E. coli
und Staphylokokken (Iyer, 1989), nachgewiesen wurden (Willis,
1999), andererseits schädigte die unreflektierte Antibiotika-Gabe
die Shrimps-Larven, bei denen Deformationen und Massensterben
die Folge waren. In Japan wurde 1990 sogar vorübergehend
der Verkauf von Shrimps aus Thailand verboten. Als Reaktion
darauf entwickelte Thailand Richtlinien zum Antibiotika-Gebrauch,
die die Antibiotika-Rückstände in Folge wieder sinken
ließen. Leider setzte sich diese Maßnahme nicht
auf internationalen Märkten durch (Macintosh, 1992). Controlling-Programme
testen lediglich eine Probe pro 100 Tonnen. Reilly und Käferstein
proklamierten den Missbrauch von Veterinärmedikamenten
1997 daher als erstrangiges Problem der Lebensmittelsicherheit.
In
der EU sind Chinolone zur Prophylaxe in der Veterinärmedizin
verboten. Häufig wird dieses Verbot dadurch umgangen, dass
einzelne Tiere weiter in der Herde gehalten werden, aber die
gesamte Herde „therapiert“ wird.
Häufige
Fehler bei einer antimikrobiellen Therapie sind falsche Darreichungsformen,
unsachgemäße Kombinationen von Wirkstoffen, nicht
ausreichend hohe Dosierungen oder die Nichtbeachtung des Dosierungsintervalls
und der Therapiedauer. Die Wahl des geeigneten Antibiotikums
sollte sich daher am möglichen Erreger sowie wenn nötig
an einem erstellten Antibiogramm inkl. Resistenztestung und
Bestimmung der MHK orientieren. So ist einerseits eine optimale
Therapie für das Tier gewährleistet, andererseits
wird die Resistenzbildung minimiert. Einen Überblick über
die aktuelle Resistenzsituation von Campylobacter in Österreich
am Beispiel eines gebräuchlichen Chinolons gibt Abbildung
1.
Abbildung
1: Ciprofloxacin-Resistenzsituation in Österreich
2005

Die
hohen Resistenzraten sind Ausdruck der früher durchgeführten
Prophylaxe mit Chinolonen in der Geflügelzucht –
sie sollten bei strikter Einhaltung der EU-Richtlinien wieder
sinken.
Chinolon-resistente
Campylobacter-Spezies stellen ein gutes Beispiel für
die negative Auswirkung der ungezielten Chinolontherapie dar.
Die Übertragung ist auch über Ausscheidungen der Tiere,
die resistente Erreger enthalten, gegeben. Weiters können
Antibiotika-Rückstände im Tierfleisch in der menschlichen
Darmflora zu einer Resistenzentwicklung bestimmter Keime führen.
Die Gefahr liegt hier bei intensivem Kontakt mit Nutz- oder
Haustieren im Austausch von Resistenzgenen mit humanpathogenen
Keimen sowie in der Infektion des Menschen mit neuen, resistenten
Keimen. Beispielsweise führt eine unkontrollierte Therapie
(Prophylaxe) mit Fluorchinolonen bei Zuchttieren zu einer Selektion
und Kolonisation der Tiere mit Campylobacter spp. In
weiterer Folge erhalten wir kontaminiertes Schlachtgut mit resistenten
Erregern, das dann im Supermarkt zum Verkauf gelangt. Beim Verzehr
erkrankt der Mensch an einer Campylobacterenteritis, welche
aufgrund der Resistenzlage nicht mehr therapierbar ist. Eine
ernste Bedrohung stellt dies bei immunsupprimierten Patienten
dar.
Tabelle:
Chinolone in der Veterinärmedizin
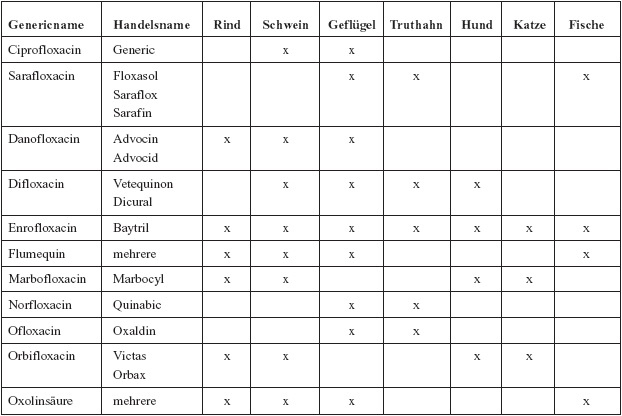
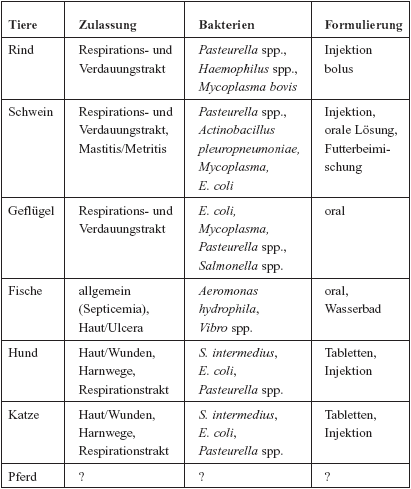
Tabelle:
Indikationen für Chinolone in der Veterinärmedizin
|
Literatur
| Iyer
T.S.G., Shrivastava K.P.: „Incidence and low temperature
survival of Salmonella in fishery products.“ Fish
Technol. 26 (1989)39-42. |
| Reilly
A., Käferstein F.: „Food safety hazards and the
application of the principles of the hazard analysis and
critical control point (HACCP) system for their control
in aquaculture production.“ Aquaculture research.
28 (1997) 735-752. |
| Macintosh
D.J., Phillips M.J.: „Environmental issues in shrimp
farming.“ In: DeSaram H. and T. Singh (Eds.): Shrimp
'92: Proceedings of the 3rd Global Conference of the Shrimp
Industry, Hong Kong. 14-16 Sept. 1992. Infofish, Kuala Lumpur,
Malaysia: (1992) 118-145. |
| Sárközy
G.: „Quinolones: a class of antimicrobial agents.“
Vet.Med. - Czech, 46, 2001 (9-10) 257-274. |
| Jahresbericht
2005 der Nationalen Referenzzentrale für Campylobacter,
Gebhard Feierl. |
Korrespondierender
Autor:
Univ.-Prof. DDr. Wolfgang Graninger
Univ.-Klinik für Innere Medizin I, Klin. Abt.für Infektionen
und Tropenmedizin
A-1090 Wien, Währinger Gürtel 18-20
E-Mail: wolfgang.graninger@meduniwien.ac.at
|
|
|