| Chinolone 2007
– Ein Update |
H. Burgmann
Univ.-Klinik für Innere Medizin I, Klin. Abt. für
Infektionen und Tropenmedizin, Medizinische Universität
Wien |
|
|
Schlüsselwörter:
Antiinfektiva, Chinolone, Pharmakodynamik, Resistenz, Nebenwirkungen |
|
Zusammenfassung
Fluorchinolone
sind seit vielen Jahren im klinischen Alltag bewährte und
zigtausendfach verordnete Antiinfektiva. Zu den großen
Vorteilen der Gruppe zählen unter anderem die hervorragenden
pharmakokinetischen Eigenschaften, insbesondere die parenteral-orale
Äquivalenz oder aber auch das breite Wirkspektrum.
In
den letzten Jahren haben sich unter den vielen Substanzen drei
Vertreter durchgesetzt, mit denen man eigentlich alle möglichen
Chinolon-indikationen abdecken kann: Ciprofloxacin, Levofloxacin
und Moxifloxacin. Durch den unkritischen Umgang mit den Fluorchinolonen
in den letzten Jahren sind wir heute mit einer steigenden Fluorchinolonresistenz
von Keimen konfrontiert, die früher ausgezeichnet mit diesen
Substanzen therapiert werden konnten (z.B. E. coli,
Salmonellen). Die Erfahrung der letzten Jahre hat weiter gezeigt,
dass die adäquate Dosierung maßgeblich die Effektivität
beeinflusst und Unterdosierungen unbedingt vermieden werden
müssen.
|
Key-words:
Antiinfektiva, Quinolones, pharmaco-dynamics, resistance,
toxicity |
|
Summary
Quinolones
are one of the largest classes of antimicrobials used worldwide.
No other class of antimicrobial agents has grown so rapidly
or been developed with such interest by pharmaceutical research
companies. Advantages of the quinolones are excellent pharmacological
properties and its wide microbiological coverage. Recently three
compounds are used in clinical practice: ciprofloxacin, levofloxacin
and moxifloxacin.
In
recent years quinolones have been overused in many settings,
and this misuse has led to the emergence of resistance to the
class (E. coli, Salmonella, ...).
The
challenge to all clinicians is to understand when to prescribe
the quinolones, so that appropriate use is maximized. Prudent
application of these agents lengthens their clinical use, and
it is hoped delays emergence of resistance.
|
Einleitung
Mit
mehr als 800 Millionen Verordnungen weltweit zählen die
Chinolone zu den wichtigsten Antiinfektiva-Gruppen. Ursprünglich
in den Siebzigern für Harnwegsinfektionen in Verwendung,
wurde das Indikationsspektrum der neu entwickelten Chinolone
weit verbreitert und betrifft heute fast alle Kompartimente
des Körpers. Das Wissen über den Zusammenhang zwischen
Struktur und Aktivität führte zu enormen Anstrengungen,
neue Substanzen mit einem breiteren Spektrum, höherer intrinsischer
Aktivität und einem verbesserten pharmakokinetischen Profil
zu synthetisieren. Es wird geschätzt, dass bisher etwa
10.000 Neumoleküle dieser Substanzgruppe generiert wurden.
Diese Anstrengungen wurden aber durch das Auftreten von Resistenzen
und für einige dieser Moleküle unakzeptablen Nebenwirkungen
beeinträchtigt. |
| Chinolone
– Struktur und Wirkweise Die
derzeit verwendeten Chinolone weisen alle die typische Grundstruktur
mit einer Ringkette, dem N-Molekül in Position 1, der Carboxylgruppe
in Position 3 und einer Carbonylgruppe in Position 4 auf. Der
F-Rest in Position 6 trägt wesentlich zur Wirkungsverstärkung
der Fluorchinolone bei. Die chemischen Eigenschaften der Seitenkette
der unterschiedlichen Substanzen entscheiden über das pharmakologische
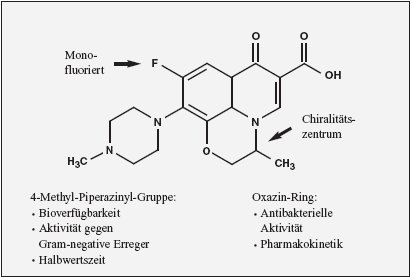
Profil wie aber auch die Toxizität (Abbildung 1).
Abbildung
1: Struktur-Wirkungs-Beziehungen bei Levofloxacin
1962
als Nebenprodukt der Anti-Malaria-Forschung entdeckt, ist die
Nalidixinsäure die Muttersubstanz der Chinolone. Die Verwendung
der Nalidixinsäure war aufgrund des schmalen Spektrums,
der geringen Serumspiegel und der Toxizität ziemlich begrenzt.
Es begann nun eine intensive Suche nach der Struktur-Aktivitäts-Relation
mit dem Ziel, die Aktivität des Antiinfektivums zu erhöhen.
Viele Chinolonmoleküle wurden patentiert, aber nur einige
wenige erreichten die Marktreife. Die derzeit erhältlichen
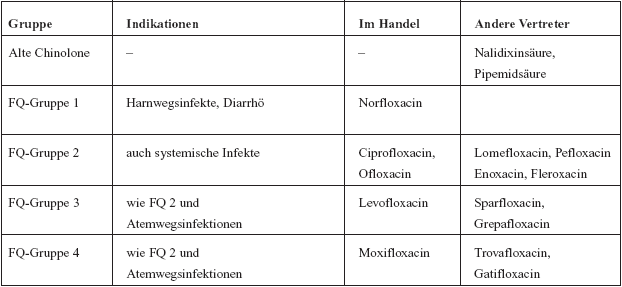
Chinolone werden in 4 Gruppen, hauptsächlich auf Basis
ihrer Wirkung, eingeteilt (Tabelle 1).
Tabelle
1: Einteilung der Chinolone
|
| Wirkweise
von Chinolonen
Fluorochinolone wirken über eine Blockierung der bakteriellen
DNA-Synthese durch Hemmung der Enzyme DNA-Gyrase und Topoisomerase
4 – beide Enzyme sind für das Bakterienwachstum essenziell.
Bei Gram-negativen Bakterien ist das bevorzugte Ziel der Chinolonwirkung
die DNA-Gyrase, bei Gram-positiven Erregern die Topoisomerase
4. Neben der Art des Erregers spielt aber auch die Art des Chinolons
eine Rolle für die bevorzugte Zielstruktur: Ciprofloxacin
wirkt bevorzugt an der Topoisomerase, Moxifloxacin an der DNA-Gyrase.
|
| Chinolone
– Wirkspektrum Die
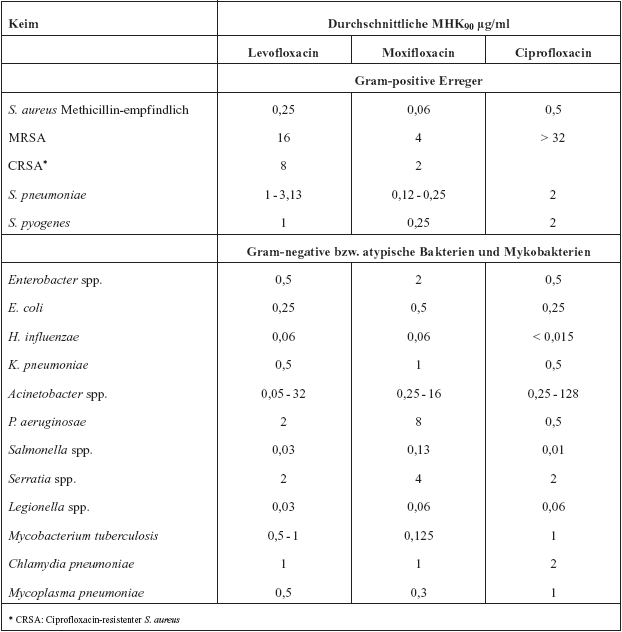
Chinolone zeichnen sich durch ein breites antibakterielles Wirkspektrum
aus (Tabelle 2).
Entsprechend
ihres Wirkspektrums werden die Fluorchinolone in 4 Gruppen eingeteilt
(siehe Tabelle 1).
Tabelle
2: Chinolon-Wirkspektrum im Vergleich
Chinolone
der Gruppe 1:
Norfloxacin
Das Wirkspektrum von Norfloxacin umfasst im Wesentlichen die
Enterobacteriaceae. Gegen Gram-positive und „atypische“
Erreger ist es unwirksam.
Fluorchinolone
der Gruppe 2:
Ciprofloxacin
Ciprofloxacin hat eine sehr gute Wirksamkeit gegen Enterobakterien
und Haemophilus influenzae und eine schwache Wirkung
auf Staphylokokken und Pneumokokken sowie auf die Chlamydien,
Legionella und Mykoplasmen. Die Aktivität gegen Pseudomonas
aeruginosa ist gut. Zugelassene Indikationen sind unkomplizierte
und komplizierte Infektionen durch nachgewiesene oder vermutete
empfindliche Erreger der Niere und/oder ableitenden Harnwege,
des HNO-Bereichs, der Atemwege (nicht bei Pneumokokken), des
Bauchraums, der Genitalorgane, der Knochengelenke, der Haut-
und Weichteile und der Sepsis, sowie bei Infektionen oder zur
Prophylaxe der neutropenischen Patienten, zur peroralen Therapie
von neutropenischem Fieber bei Patienten der Risikogruppe 1
(in Kombination mit Amoxicillin), zur selektiven Darmdekontamination
bei immunsuppressiv behandelten Patienten und bei akuten Infektionsschüben
zystischer Fibrose bei Kindern und Jugendlichen im Alter von
5 bis 17 Jahren.
Fluorchinolone
der Gruppe 3:
Levofloxacin
Levofloxacin hat eine im Vergleich zu Ciprofloxacin verbesserte
intrinsische Aktivität gegen Gram-positive Erreger, wie
Staphylokokken, Streptokokken und Pneumokokken, sowie die atypischen
Erreger Legionellen, Chlamydien und Mykoplasmen. Die Aktivität
gegen Gram-negative Erreger ist vergleichbar, allerdings gegen
Pseudomonas aeruginosa etwas schwächer. Levofloxacin
ist das linksdrehende Enantiomer und damit der wirksame Anteil
des Racemats Ofloxacin. Zugelassene Indikationen für das
Levofloxacin sind ambulant erworbene Pneumonie, komplizierte
Harnwegsinfektionen, Haut- und Weichteilinfektionen. Weiters
konnte Levofloxacin auch erfolgreich bei der empirischen Behandlung
des neutropenischen Patienten mit Low-risk eingesetzt werden.
Derzeit läuft die Studie zur Verwendung von Levofloxacin
bei der Hospital-acquired-Pneumonia. Levofloxacin ist oral und
parenteral verfügbar.
Fluorchinolone
der Gruppe 4:
Moxifloxacin
Moxifloxacin hat ein sehr breites Wirkspektrum gegen zahlreiche
aerobe und anaerobe Gram-negative und Gram-positive Erreger,
einschließlich der atypischen Erreger. Im Vergleich zu
Levofloxacin besitzt es eine verbesserte Aktivität gegen
Gram-positive Erreger wie Staphylokokken und Streptokokken,
einschließlich der Pneumokokken, gegen Anaerobier. Gegenüber
Pseudomonaden besitzt es keine ausreichende Aktivität.
In Alveolarmakrophagen werden überlange Zeit hohe Konzentrationen
erreicht. Moxifloxacin ist oral und parenteral verfügbar.
Als Einsatzgebiet sind ambulant erworbene Pneumonien aller Schweregrade
zugelassen und auch der diabetische Fuß bzw.die schwere
Weichteilinfektion.
|
| Chinolone
– Resistenzmechanismen Bakterien
können auf zwei prinzipielle Arten gegen Chinolone resistent
werden: Reduktion der intrazellulären Wirkstoffkonzentration
oder Modifikation des Wirkortes.
Die
typische Chinolonresistenz entsteht schrittweise durch Mutation
der Gene, die die DNA-Gyrase und Topoisomerase 4
codieren. Durch eine erste Mutation entsteht eine Low-Level-Resistenz,
die im Routineantibiogramm nicht zu erkennen ist; gefolgt von
einer zweiten Mutation, die dann die phänotypische Resistenz
erzeugt. Diese Form der Resistenz ist chromosomal und daher
nicht übertragbar, findet sich aber durch klonale Ausbreitung
mit zunehmender Häufigkeit. Ein weiterer wichtiger Resistenzmechanismus
ist die intrinsische Low-Level-Resistenz durch verminderte
Membranpermeabilität. Durch Herabregulation von
Porinen verschlechtert sich die Diffusion von Chinolonen durch
die Membran.
Die Abregulation der intrinsischen MDR-Effluxpumpen
erniedrigt die intrazellulären Konzentrationen von Chinolonen
und anderen Antibiotika und verursacht ebenfalls eine Low-Level-Resistenz
– damit scheinen die Erreger vor niedrigen Chinolonspiegeln
geschützt zu sein. Suboptimale Wirkspiegel gelten daher
auch als wesentlicher Risikofaktor für Resistenzinduktion.
Durch weitere Mutationsschritte entsteht dann das Vollbild der
resistenten Erreger. Da diese Effluxpumpen eine Reihe von Substanzen
aus der Zelle entfernen, werden dadurch auch Co-Resistenzen
gegen andere antiinfektive Wirkstoffgruppen begünstigt.
Quantitativ betrachtet haben Topoisomerasen-Mutationen und Efflux
die größten Auswirkungen auf die MHK. |
| Pharmakokinetik
und Pharmakodynamik der Chinolone Alle
Fluorchinolone verteilen sich extra- und intrazellulär,
deshalb haben sie im Vergleich zu den Betalaktamen ein hohes
relatives Verteilungsvolumen (1-4 l/kg) und zeigen eine sehr
gute Gewebegängigkeit. Die Proteinbindung der verfügbaren
parenteralen Vertreter liegt in der Regel unter 40%. Levofloxacin
wird ausschließlich renal eliminiert, Ciprofloxacin wird
neben der renalen Ausscheidung auch hepatisch und intestinal
ausgeschieden. Moxifloxacin wird praktisch ausschließlich
durch Konjugationsreaktion eliminiert (Tabelle 3).
Die meisten Chinolone haben eine exzellente Bioverfügbarkeit,
die sie ideal für die Behandlung ambulanter Patienten und
für die antimikrobielle Switch-Therapie von intravenös
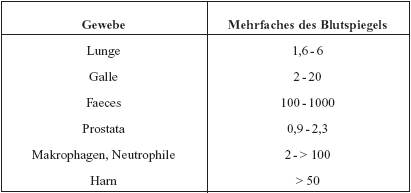
auf per oral machen. Sie sind auch charakterisiert durch eine
exzellente Penetration in die meisten Gewebe und Körperflüssigkeiten
(Tabelle 4).
Frühe
Studien zeigten, dass Chinolone, ähnlich wie die Aminoglykoside,
hauptsächlich konzentrationsabhängig wirken und einen
doch beträchtlichen postantibiotischen Effekt aufweisen.
Untersuchungen zeigen, dass eine Cmax/MHK-Rate
von größer 10 erreicht werden sollte. Wichtiger scheint
allerdings die Substanzmenge im Verhältnis zur MHK zu sein
(AUC 24/MHK). Die Chinolone waren die erste antiinfektive Substanzgruppe,
bei der diese pharmakodynamische Kalkulation zur Dosisfindung
für die Praxis eingesetzt wurde.
Tabelle
3: Pharmakokinetik einzelner Fluorchinolone

Tabelle
4: Gewebe mit hohem Chinolonspiegel
|
| PK/PD-Werte
– Prädiktoren für den Therapieerfolg?
Die
Korrelation zwischen Pharmakokinetik und Pharmakodynamik (Empfindlichkeit
des Erregers gegenüber dem Antibiotikum) kann zur Vorhersage
des voraussichtlichen Therapieerfolgs herangezogen werden. PK/PD-Werte
geben außerdem Hinweise zur Prävention von Mutation
und Resistenzen und können zur Optimierung der Dosierung
beitragen. In der Praxis haben sich vor allem folgende 3 PK/PD-Indizes
bewährt (Abbildung 2).
Abbildung
2: Pharmakokinetische Indizes
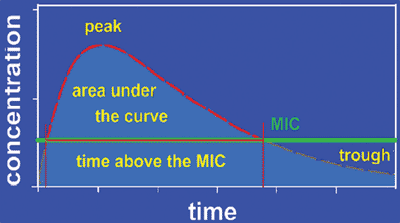
Zeit
oberhalb der MHK (bei zeitabhängig wirkenden Antibiotika):
die Zeitspanne (t in % des Dosierungsintervalles), in der die
Konzentration des Antibiotikums über der minimalen Hemmkonzentration
(MHK) des ursächlichen Erregers liegt.
Cmax/MHK
(bei konzentrationsabhängig wirkenden Antibiotika): das
Verhältnis der Antibiotikum-Spitzenkonzentration zur MHK
des Erregers.
AUC/MHK (=AUIC) (bei konzentrationsabhängig
wirkenden Antibiotika): das Verhältnis aus der Fläche
unter der 24-Stunden-Konzentrationszeitkurve (AUC 24) des Antibiotikums
und der MHK des ursächlichen Erregers.
Zeitabhängig
wirken z. B. Betalaktame und Makrolide. Dagegen ist für
Aminoglykoside und Fluorchinolone die Konzentration des Antibiotikums
entscheidend. Als bester Prädiktor für einen Therapieerfolg
in vivo gilt bei Fluorchinolonen das Verhältnis
von AUC und MHK (AUIC). Ausreichend hohe AUIC-Werte verringern
zugleich das Risiko, dass unter Therapie resistente Mutanten
selektioniert werden. Allerdings gilt auch für die Korrelation
zwischen AUIC und Resistenzentwicklung, dass die Grenzwerte
nicht verallgemeinert werden können, sondern für einzelne
Erreger unterschiedlich sind.
Generell
hat sich die Tagesdosis der Fluorchinolone in den letzten Jahren
deutlich erhöht. Wurde Ofloxacin noch mit 2x50 mg/Tag verabreicht,
so liegt heute die Tagesdosis von Levofloxacin (antimikrobiell
aktiver Teil von Ofloxacin) bei 1-2x500 mg (würde in etwa
1.000-2.000 mg Ofloxacin entsprechen) (Tabelle 5). Einschränkend
muss man aber sagen, dass viele dieser pharmakokinetischen Überlegungen
im Wesentlichen auf mathematischen Modellrechnungen beruhen
und die experimentellen Daten bisher meist nicht klinisch belegt
wurden.
Tabelle
5: Tagesdosierungen für Chinolone

|
| Nebenwirkungen
und Arzneimittelinteraktionen von Fluorchinolonen
Die
Verwendung von Chinolonen wird durch eine Reihe von unerwünschten
Nebenwirkungen (4-10%) limitiert, die zumeist mild sind, manche
können aber auch sehr schwer verlaufen und haben die Rücknahme
einzelner Präparate vom Markt hervorgerufen. Es gibt Effekte,
die alle Moleküle dieser Klasse betreffen, wenn auch mit
unterschiedlicher Frequenz, z. B. gastrointestinale Nebenwirkungen
oder Arthralgien. Eine Reihe von Chinolonen, unter anderem Temafloxacin,
Grepafloxacin, Sparfloxacin und Trovafloxacin mussten wegen
zwar seltenen, aber unakzeptablen Nebenwirkungen vom Markt genommen
werden (Tabelle 6).
Zu
den folgenschwersten Komplikationen mancher Fluorchinolone gehören
sicher die Verlängerungen der QT-Dauer und konsekutiver
Arrhythmien und Todesfälle. So darf Moxifloxacin laut Produktmonografie
nicht mehr bei kongenitalem oder bei bekanntem Long-QT-Syndrom,
Elektrolytstörung, insbesondere Hypokaliämie, klinisch
relevanter Bradykardie, klinisch relevanter Herzinsuffizienz
mit reduzierter Linksventrikelfunktion oder anamnestischen Arrhythmien
verabreicht werden. Auch für Gatifloxacin gibt es Berichte
über Todesfälle und Grepafloxacin wurde wegen vermehrter
Arrhythmien vom Markt genommen.
Tabelle
6: Nebenwirkungen von Chinolonen
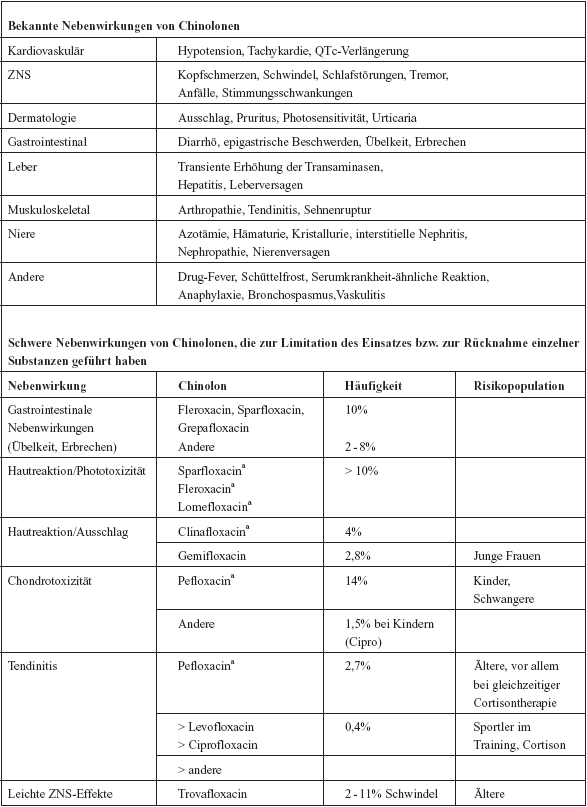
Tabelle
6 Fortsetzung: Nebenwirkungen von Chinolonen
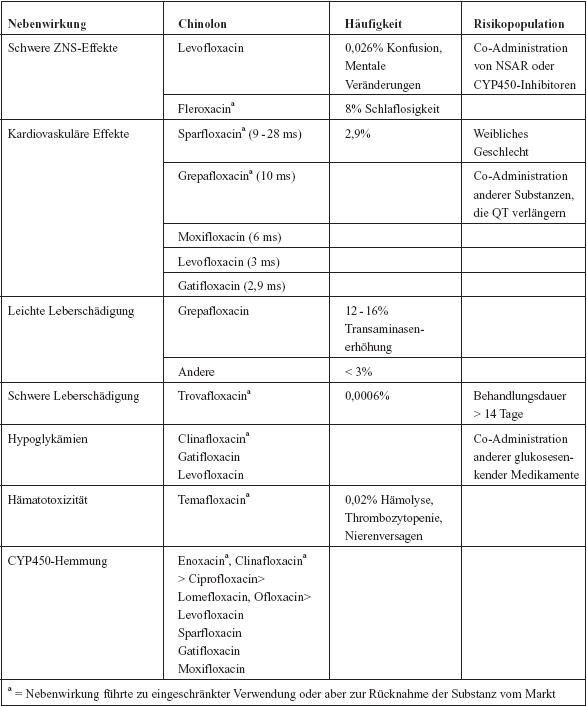
|
| Kontraindikationen
für Chinolone In
folgenden Situationen ist eine Fluorchinolongabe kontraindiziert
oder nur unter strenger Nutzen-Risiko-Abwägung möglich:
Überempfindlichkeit
gegen Chinolone
Schwangerschaft und Stillperiode
Kinder und Jugendliche bis zum 18. Lebensjahr
verlängerte QT-Dauer bei manchen Chinolonen
Patient mit zerebralen Anfallsleiden
anamnestische Chinolon-Tendinitis
Glukose-6-Phosphatdehydrogenase-Mangel bei manchen Chinolonen
Alle Chinolone sind wegen
der an jungen Hunden beobachteten Arthropathien in der Schwangerschaft
und Stillperiode kontraindiziert. Für die Schwangerschaft
gilt die FDI-Kategorie C, d. h., dass eine Gabe nur bei fehlender
Alternative und unter Risikoabwägung erlaubt ist. Studien
an Neugeborenen, deren Mütter während der Schwangerschaft
unwissentlich mit Chinolonen therapiert wurden, ergaben bisher
keinen Hinweis auf Teratogenität bei Menschen. Ist die
Gabe bei Stillenden notwendig, ist das Abstillen zu empfehlen.
|
| Chinolone
in der Pädiatrie Chinolone
gelten bei Kindern und Jugendlichen vor dem 18. Lebensjahr wegen
der bereits erwähnten Knorpelschäden bei jungen Hunden
als kontraindiziert. Im Gegensatz zu diesen tierexperimentellen
Ergebnissen wurden bislang bleibende Knorpel- oder Gelenksschäden
im klinischen Einsatz in der Pädiatrie nicht beobachtet.
Die in Entwicklung befindlichen Desfluorchinolone dürften
frei sein von möglicher Knorpeltoxizität.
Obwohl es anzunehmen ist, dass in den nächsten
Jahren auch in der Behandlung von Infektionen bei Kindern Chinolone
in einzelnen Indikationen zugelassen werden, muss heute noch
bei Patienten unter 18 Jahren der potenzielle Nutzen gegenüber
den möglichen Risiken abgewogen werden.
Die Verwendung von Fluorchinolonen kann unter
folgenden Umständen in Erwägung gezogen werden:
1. Infektion mit MDR-Pathogen, bei dem es keine
sichere oder effektive Alternative gibt.
2. Parenterale Therapie ist nicht möglich und keine andere
orale Therapie ist verfügbar.
Die Aufklärung sollte wie unter den Bedingungen
der klinischen Prüfung geschehen, das heißt, es muss
eine schriftliche Einverständniserklärung der Eltern
und in der Regel ab dem 14.Lj. auch des Patienten eingeholt
werden. Ciprofloxacin sollte bevorzugt werden, da es am besten
dokumentiert ist und eine Saftzubereitung zur Verfügung
steht. Die Applikation sollte auf folgende spezielle Indikationen
limitiert sein:
Harnwegsinfekte durch Pseudomonas aeruginosa oder
andere multiresistente, Gram-negative Erreger (z. B. Enterobacter
spp.)
Chronische suppurative Otitis media oder maligne Otitis externa
Chronische Osteomyelitis
Exazerbation einer zystischen Fibrose
Enterobakter-Meningitis, Gram-negative Meningitis beim Neugeborenen
Langzeittherapie bei Infektionen durch Gram-negative Erreger
ohne therapeutische Alternative
Schwere Salmonellen-, Shigellenenteritis
Prophylaxe systemischer Meningokokken-Infektionen
Postexpositionelle Prophylaxe bei Bacillus anthracis
|
| Immunmodulatorische
Effekte der Fluorchinolone Untersuchungen
der letzten Jahre zeigten, das Fluorchinolone sowohl auf die
zelluläre als auch die humorale Immunität wirken.
Generell benötigen sie für diese immunmodulatorischen
Effekte aber ein Co-Stimulans. Sie verursachen einerseits eine
Downregulation von proinflammatorischen Zytokinen, andererseits
eine Upregulation der Hämatopoese. Diese immunmodulatorischen
Effekte findet man vor allem bei Fluorchinolonen mit einem Cyclopropylanteil
am N1., also Ciprofloxacin oder Moxifloxacin. Die klinische
Auswirkung dieser Immunmodulation ist allerdings nicht klar.
|
| Mögliche
Indikationen von neuen Fluorchinolonen Aufgrund
ihres breiten Wirkspektrums und der doch guten Verträglichkeit
werden Chinolone häufig im klinischen Alltag verwendet
(Tabelle 7).
Allerdings
werden Chinolone leider oft unkritisch eingesetzt. In der folgenden
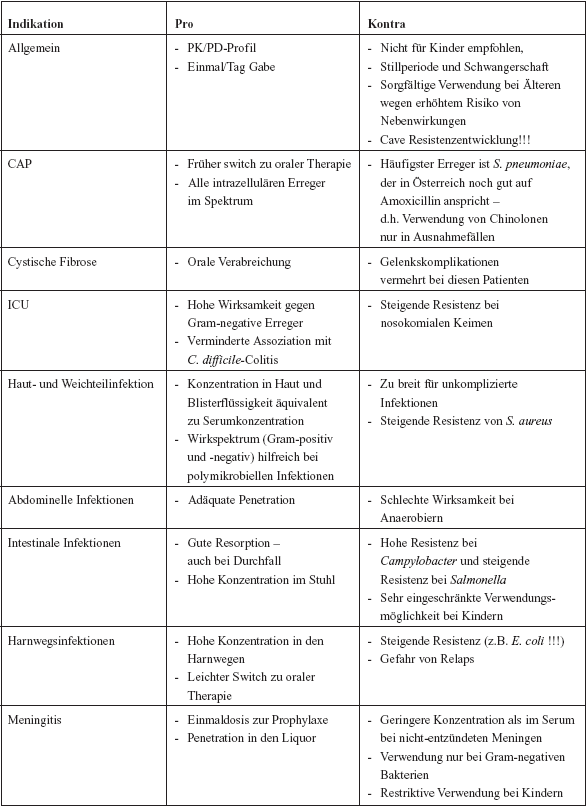
Tabelle sollen nun Pro und Kontra für den klinischen Einsatz
von Chinolonen diskutiert werden (Tabelle 8).
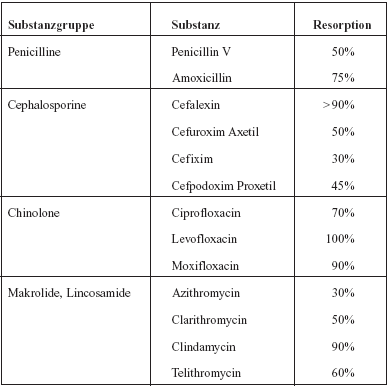
In
der oralen Infekttherapie spricht die im Vergleich zu den Betalaktamen
sehr gute Bioverfügbarkeit oft für den Einsatz von
Fluorchinolonen (Tabelle 9).
Gerade im ambulanten Bereich haben sich durch den manchmal zu
unkritischen Einsatz der Chinolone in den letzten Jahren Resistenzprobleme
ergeben (z. B. Chinolon-resistenter E. coli).
In
der Behandlung schwerer nosokomialer Infekte (Sepsis, Beatmungspneumonie)
werden heute allgemein Chinolon-Betalaktam-Kombinationen empfohlen.
Auch wenn die Evidenz dafür mittels randomisierter Studien
nicht gesichert ist, spricht der Umstand, dass lebensbedrohliche
Infekte rascher und kompetent therapiert werden müssen,
um die Infektsterblichkeit zu senken, doch für eine Kombinationstherapie.
Selbst bei kritisch Kranken ist die gute orale Resorption beispielsweise
von Levofloxacin belegt. In einer pharmakologischen Studie konnte
bei 10 Patienten an einer Intensivstation problemlos eine IV
per oral switch durchgeführt werden und die errechnete
Bioverfügbarkeit betrug 95%. Voraussetzung dafür ist
natürlich das Fehlen gastrointestinaler Störungen.
Tabelle
7: Mögliche Indikationen für neue Chinolone
(Levofloxacin, Moxifloxacin) (mod. nach den Empfehlungen der
Paul-Ehrlich-Gesellschaft für Chemotherapie)
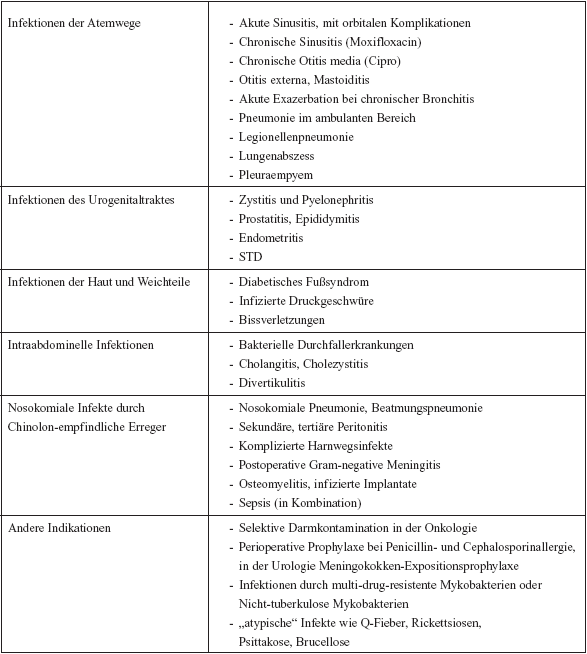
Tabelle
8: Klinische Verwendung von Fluorochinolonen: Pro und
Kontra
Tabelle
9: Vergleich der % oralen Resorption unter optimalen
Bedingungen
|
| Zusammenfassung
Mitte
der 80er Jahre des letzten Jahrhunderts wurden die Fluorchinolone
mit Fanfaren als Antwort auf zunehmende Infektionen mit Gram-negativen
Bakterien begrüßt.
Durch Molekülmodifikationen versuchte man die Wirksamkeit
dieser Substanzgruppe zu optimieren, oftmals leider auf Kosten
der Verträglichkeit. So erreichten zahlreiche Chinolone
nicht die Marktreife und einige mussten nach der Zulassung aufgrund
schwerwiegender Nebenwirkungen wieder zurückgenommen werden.
Bei den derzeit in Österreich verfügbaren Substanzen
handelt es sich um sehr effektive Antiinfektiva mit breitem
Wirkspektrum. Die inadäquate und zahlreiche Anwendung hat
in den letzten Jahren allerdings zunehmende Resistenzraten auch
bei früher hoch sensiblen Keimen wie E. coli hervorgerufen.
Bei
Fortbestehen dieses Trends könnte die klinische Wertigkeit
dieser heute sehr potenten Substanzen bald deutlich eingeschränkt
sein.
Es liegt am gezielten Einsatz der Chinolone – nicht zuletzt
im niedergelassenem Bereich – die Resistenzrate möglichst
niedrig zu halten.
|
Literatur
| Van
Bambeke F., Michot J.M., Van Eldere J.:„Quinolones
in 2005: An update.“ Clin.Microbiol. Infect. 11 (2005)
256-280. |
| .O'Donnell
J.A., Gelone S.P.: „The newer fluoroquinolones.“
Infect. Dis. Clin. N. Am. 18(2004) 691-716. |
| Domagala
J.M., Hagen S.E.: „Structure-activity relationships
of the quinolone antibacterials in the new millenium: somethings
change and some do not.“ In: Hooper D.C., Rubinstein
E., eds.: „Quinolone antimicrobial agents.“
Washington, DC:ASM Press (2003) 3-18. |
| Andersson
M.I., MacGowan A.P.: „Development of the quinolones.“
J. Antimicrob.Chemother. 51 (supp. l1) (2003) 1-11. |
| Lesher
G.Y., Froelich E.J., Gruett M.D.:„1,8-naphtyridine
derivatives. A new class of chemotherapeutic agents.“
J. Med.Pharm. Chem. 91 (1962) 1063-1065. |
| Sprandel
K.A., Rodvold K.A.: „Safety and tolerability of fluoroquinolones.“
Clin. Cornerstone Supple 3 (2003) 29-236. |
| Sanders
C.C.: „Mechanisms responsible for cross-resistance
and dichotomous resistance among the quinolones.“
Clin. Infect. Dis. 32 Supple (2001) 1-8. |
| Ambrose
P.G., Bhavnani S.M., Owens R.C.:„Clinical pharmacodynamics
of quinolones.“ Infect. Dis. Clin. N. Am. 17 (2003)
529-543. |
| Emami
S., Shafiee A., Foroumadi A.:„Structural features
of new quinolones and relationship to antibacterial activity
against Gram-positive bacteria.“ Mini Rev. Med.Chem.
6 (2006) 375-86. |
| Dalhoff
A.: „Immunmodulatory Activities of Fluoroquinolones.“
Infection Supple 2 (2005) 55-70. |
| Committee
on Infectiuos Diseases: „The use of systemic fluoroquinolones.“
Pediatrics 118 (2006) 1287-1292. |
| Jumbe
N.L., Louie A., Miller M.H., et al.:„Quinolone efflux
pumps play a central role in emergence of fluoroquinolone
resistance in Streptococcus pneumoniae.“
Antimicrob. Agents Chemother. 50 (2006) 310-317. |
| Hutschala
D., Skhirtladze K., ZuckermannA., et al.: „In
vivo measurement of levofloxacin penetration into lung
tissue after cardiac surgery.“ Antimicrob. Agents
Chemother. 49, 5107-11. |
Anschrift
des Verfassers:
a. Univ.-Prof. Dr. Heinz Burgmann
Univ.-Klinik für Innere Medizin I, Klin. Abt.für Infektionen
und Tropenmedizin
A-1090 Wien, Währinger Gürtel 18-20
E-Mail:heinz.burgmann@meduniwien.ac.at
|
|
|