Infekttherapie
beim kritisch Kranken |
| O. Janata
Krankenhaushygiene, Donauspital im SMZ-Ost, Wien
(Leiter: OA Dr. Oskar Janata) |
|
| Der
chronisch morbide und gleichzeitig akut kranke Patient in Kombination
mit invasiver Medizin schafft ein Infektionsproblem. Bis zu
80% der Patienten an einer Intensivstation haben daher Kontakt
mit Antibiotika. Der hohe Antibiotikaverbrauch erklärt
sich teilweise auch durch die Tatsache, dass viele Betroffene
eine Kombination aus zwei oder mehr Antibiotika erhalten (Tabelle
1).
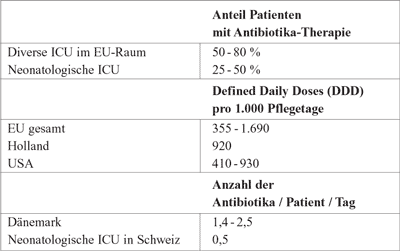
Tabelle
1: Antibiotikaverbrauch an der ICU, Hanberger H. et
al., AntibioticPolices 2005
|
Auswahlkriterien
Bei der
Wahl eines Antibiotikums an der ICU ist das Wirkspektrum,
beruhend auf Diagnose-typischen Erregern, die hauseigenen
Resistenzdaten und die Daten aus der laufenden Surveillance
abzüglich der „Not-to-treat-Liste“ zu berücksichtigen.
Im Zweifelsfall ist es legitim, bei vitaler Bedrohung auf
ein Breitspektrum-Antibiotikum zurückzugreifen. Wie Studien
zeigen, besteht einerseits keine Gefahr den Patienten zu übertherapieren,
andererseits gibt es jedoch die Möglichkeit, durch zuwenig
Therapie dem Patienten Schaden zuzufügen.
Die richtige
Dosis ist ein wichtiger Faktor. Hochdosierte Betalaktame zählen
heute zum Standard, es ist aber auch nötig, die Grundsätze
der Pharmakokinetik und der Pharmakodynamik zu berücksichtigen.
Vor allem auf eine entsprechende Gewebegängigkeit ist
zu achten.
|
Therapiemöglichkeiten
Der
kritisch Kranke braucht eine adäquate Behandlung. Die klassischen
Guidelines werden jedoch immer weniger brauchbar, da hausinterne
Verhältnisse eine immer bedeutendere Rolle spielen. Eine
Möglichkeit, geeignete Antibiotika für die eigene
ICU zu suchen, besteht darin, die Blutkulturen und damit die
anzunehmenden invasiven Isolate auszuwerten. Während im
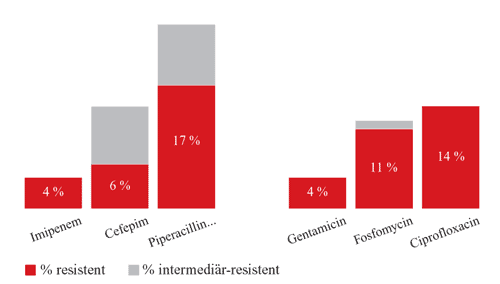
Gram-positiven Bereich bezüglich der Empfindlichkeit gegen
Antibiotika wie Imipenem, Piperacillin/Tazobactam und Cephalosporinen
der 4. Generation kaum Unterschiede bestehen, geben diese Resistenzdaten
einen guten Überblick, welche Antibiotika zurzeit gegen
Gram-negative Keime gut einsetzbar sind (Abbildung
1). Über die richtige Vorgehensweise bei als intermediär
empfindlich ausgetesteten Keimen kann man diskutieren; in Frage
kommt eine Anwendung besonders hoher Dosen oder die Kombination
mit einer zweiten Wirksubstanz. Unter den typischen „Kombinationsantibiotika“
bietet Gentamicin eine gute Resistenzlage, der Einsatz ist wegen
Toxizität der Substanz allerdings immer kritisch zu prüfen.
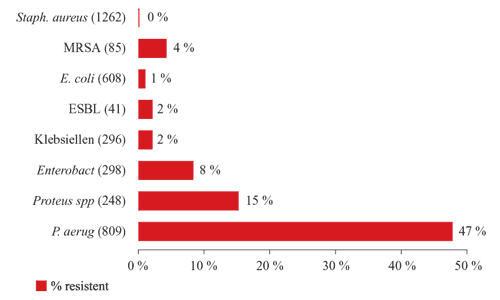
Fosfomycin ist nicht nur ein sehr gutes Staphylokokkenantibiotikum,
sondern hat auch ein wesentlich breiteres Wirkspektrum im Gram-negativen
Bereich (inkludiert z.B. auch ESBL-Organismen) und bietet sich
daher als Kombinationspartner an (Abbildung
2 und 3).
Abbildung
1: Gram-negative Erreger in der Blutkultur, 106 Isolate
– Donauspital 2005
Abbildung
2: Fosfomycin – In vitro-Aktivität, Donauspital
2005
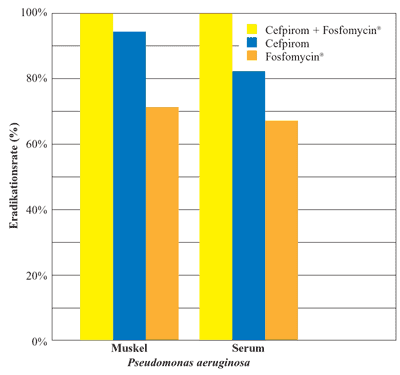
Abbildung
3: Synergistische Wirkung von Cefpirom und Fosfomycin
gegen Pseudomonas aeruginosa-Stämme, Zeitlinger
M.A. et al., 2003
|
Resistenzbeobachtung
An
Intensivstationen gehört vor allem die Resistenzlage von
Pseudomonas aeruginosa regelmäßig beobachtet
und dokumentiert. Typisch ist zurzeit eine Resistenzzunahme
bei Penemen, während die Resistenzzahlen bei Chinolonen
stabil sind. Dieser Vergleich hat insofern aktuelle Bedeutung,
als in den letzten Jahren die Resistenzen gegen Chinolone z.B.
bei simplen E. coli stark gestiegen sind. Eine paradoxe
Situation mit einer einfachen Erklärung: Durch die häufige
und niedrig dosierte ambulante Anwendung von Chinolonen bei
Harnwegsinfekten sind die Resistenzen gegen E. coli
gestiegen, während auf der ICU diese Substanzen mit Bedacht
und hoch dosiert angewendet werden.
Die
möglichen Resistenzen gegen Peneme haben auf die primären
Therapieentscheidungen allerdings keinen Einfluss, da die Abnahme
der Empfindlichkeit von Pseudomonas aeruginosa erst nach 2 -
3 Wochen Liegedauer an der Intensivstation zum Tragen kommt.
Ob sich durch eine Kombinationstherapie diese Resistenzen verhindern
lassen, ist fraglich. In den diversen Studien erhielten zwischen
40% und 75% der Patienten mit sekundär resistent gewordenen
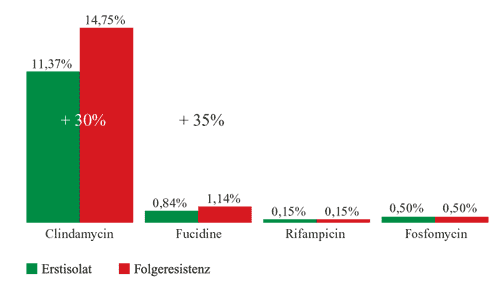
Pseudomonaden primär eine Kombinationstherapie. Bei Staphylokokken-Infektionen
ist die Indikation zur Kombinationstherapie gar nicht so selten
gegeben. Neben der „Intensivierung“ der Therapie
durch gewebegängige Antiinfektiva, mit denen auch in schwierigen
Kompartimenten wie Abszessen ein Behandlungserfolg erzielt werden
kann, spricht auch die Resistenzzunahme bei Substanzen, die
meist als Monotherapie verabreicht werden (Clindamycin, Fusidinsäure),
für eine Kombination, da Antiinfektiva die üblicherweise
in Kombination eingesetzt werden, dieses Problem weniger haben
(Rifampicin, Fosfomycin) (Abbildung 4).
Abbildung
4: Staphylococcus aureus-Resistenzen, ca.
1.300 klinische Isolate, Donauspital 2005
|
Gewebegängigkeit
Gerade
bei ZNS-Infektionen ist die ausreichende Penetration an den
Zielort ein wichtiger Faktor für das Therapieergebnis.
Zurzeit ist die Kombination eines Betalaktams mit einem gut
penetrierenden Antibiotikum wie Fosfomycin üblich. Ein
pharmakodynamischer Therapieansatz ist die kontinuierliche Verabreichung
des Antibiotikums mittels Perfusor, allerdings konnte die Wertigkeit
dieser Methode selbst bei problematischen Erregern aus verschiedensten
Gründen bisher nicht schlüssig bewiesen werden. Bei
Keimen, die als hochempfindlich auf ein Antibiotikum ausgetestet
sind, ist eine kontinuierliche Gabe auf jeden Fall unnötig.
Außerdem verändern sich bei kritisch kranken Patienten
die pharmakokinetischen Werte, auch eine verlängerte Halbwertszeit
bei eingeschränkter Nierenfunktion spricht gegen die kontinuierliche
Applikation von Antiinfektiva.
Die
übliche Angabe vom Anteil des Gewebespiegels in Prozent
des Blutspiegels kann bezüglich der Fähigkeit zur
Gewebepenetration täuschen, es sind die tatsächlich
vor Ort erzielten Wirkspiegel im Vergleich mit den MHK-Werten
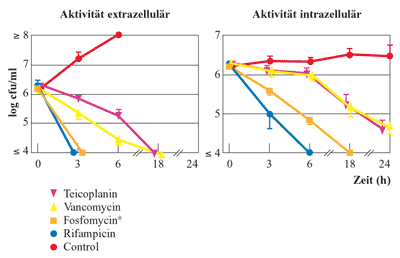
für die Therapie relevant. Heute ist bei der Bestimmung
der Gewebegängigkeit die Mikrodialyse Standard. Eine typische
Schwäche der großmolekularen Substanzen, d.h. auch
aller Betalaktame, ist die mangelhafte intrazelluläre Penetration
(Abbildung 5). Hier sind kleine Moleküle,
wie Fosfomycin, deutlich besser.
Abbildung
5: Liquorgängigkeit von Vancomycin bei Drain-assoziierter
Ventrikulitis
|
Anschrift
des Referenten:
OA Dr. Oskar Janata
Krankenhaushygiene, Donauspital im SMZ-Ost
A-1220 Wien, Langobardenstraße 122
E-Mail: oskar.janata@wienkav.at
|