Poststreptokokken-Glomerulonephritis
in Kindernohne ersichtliche Streptokokkenerkrankung –
Ein Fallbericht und Diskussion adäquater Gegenmaßnahmen |
| R. Sauermann 1, 2,
R. Gattringer 1, H. Ibel 3, H. Lagler
1, W. Emminger 4, W. Graninger 1,
A. Georgopoulos 1
* 1 Univ.-Klinik für Innere Medizin I, Klin.
Abt. für Infektionen und Chemotherapie, MUW
2 Univ.-Klinik für Klinische Pharmakologie,
Abt. für Pharmakokinetik, MUW
3 Pädiatrische Ambulanz, 97440 Werneck, Deutschland
4 Univ.-Klinik für Kinder- und Jugendheilkunde,
MUW
*(Korrespondierender Autor: Univ.-Prof. DDr. A. Georgopoulos) |
|
Schlüsselwörter
S. pyogenes, Ausbruch, Kindergarten, Glomerulonephritis,
Intervention |
|
Zusammenfassung
Nach
einem Scharlachausbruch in einem bayrischen Kindergarten erkrankten
zwei Kinder, die keine Infektionszeichen aufwiesen, an einer
Poststreptokokken-Glomerulonephritis. Derartige Fälle sind
möglich, weil die Maßnahmen, die bei einem Ausbruch
von Streptococcus pyogenes-Erkrankungen in der Regel
ergriffen werden, die Risiken für akut infizierte, aber
asymptomatische Kinder nicht berücksichtigen. Nach der
Präsentation dieses Falles werden verschiedene Interventionsstrategien
für Kinderbetreuungseinrichtungen diskutiert, die von einem
Krankheitsausbruch mit S. pyogenes betroffen sind.
Im vorliegenden Bericht war der auslösende S. pyogenes-Stamm
vom emm12-Typ. Pulsfeld-Gelelektrophoreseuntersuchungen
von 78 Isolaten deuten auf ein endemisches Auftreten (14%) dieses
Stammes (Pulsotyp 1) in Bayern.
Schlussfolgerung:
Aufgrund des Risikos von nicht-infektiösen Folgeerkrankungen
in akut infizierten, aber asymptomatischen Kindern sollte bei
dem Auftreten einer Streptokokkenepidemie in einem Kindergarten
rasch eine Screeninguntersuchung oder eine antibiotische Behandlung
für alle Personen aus der betroffenen Klasse oder Institution
eingeleitet werden. Dabei muss auf die Compliance besonderes
Augenmerk gelenkt werden.
|
Key-words
S. pyogenes, outbreak, kindergarten, glomerulonephritis,
intervention |
|
Summary
Two
children without clinical symptoms of infection fell ill from
post-streptococcal glomerulonephritis after an outbreak of scarlet
fever in a Bavarian kindergarten. Such cases occur because the
measures routinely applied during outbreaks of Streptococcus
pyogenes disregard the risks for acutely infected but asymptomatic
children.
After presentation of the case, different intervention strategies
for child care institutions affected by streptococcal outbreaks
are compared and discussed.
In the present case, the causative strain of S. pyogenes
was of the emm12-type. Pulsed-field gel electrophoresis
of 78 isolates indicated endemic occurrence (14%) of this strain
(pulsotype 1) in Bavaria. Conclusion: Due to the risk of poststreptococcal
sequelae in acutely infected but asymptomatic children during
outbreaks of streptococcal disease in a kindergarten, either
screening tests or effective antimicrobial treatment should
be instituted rapidly in the entire class or institution. Hereby,
the compliance especially of very young individuals should be
considered.
|
Einleitung
Trotz
ihrer geringen Mortalität sind durch Streptococcus
pyogenes hervorgerufene Infektionen wegen des Risikos von
postinfektiösen Folgeerkrankungen immer noch von besonderer
klinischer Bedeutung [1]. Die Gefahr von rheumatischem Fieber
und Glomerulonephritis (GN), sowie Hinweise auf ein erhöhtes
Risiko für chronische GN bei Erwachsenen, die in ihrer
Kindheit eine Poststreptokokken-GN durchgemacht haben [2], unterstreichen
die Wichtigkeit adäquater Diagnose und Behandlung von Streptokokkeninfektionen.
Die Pathogenese der Poststreptokokken-GN ist ein vielseitiger
Prozess, der von zahlreichen Faktoren sowohl des auslösenden
Streptokokkenstammes als auch des menschlichen Wirts abhängt
[3, 4]. Insbesondere S. pyogenes-Stämme der Serotypen
M1, 4, 12 und 25 sind mit GN nach Racheninfektionen assoziiert
[3, 5]. Verschiedene Analysen zeigten, dass innerhalb eines
Serotyps von S. pyogenes genetisch voneinander abweichende
Stämme bestehen können [6, 7, 8, 9]. Dies erklärt,
warum nicht alle Stämme eines als „nephritogen“
eingestuften Serotyps die Fähigkeit besitzen, eine Poststreptokokken-GN
zu induzieren [10].
Als
im Rahmen einer Studie die antimikrobielle Resistenz von S.
pyogenes in Bayern systematisch untersucht wurde [11],
wurde ein Scharlachausbruch in einem Kindergarten beobachtet.
Hierbei trat nahezu zeitgleich eine GN in zwei Kindern auf,
die zuvor keine symptomatische Streptokokkeninfektion durchgemacht
hatten. Dies war Anlass, die derzeitige Handhabung solcher Ausbrüche
zu hinterfragen, um die Entstehung von Poststreptokokken-Erkrankungen
bei Kindern in Zukunft besser zu verhindern. Denn trotz umfangreichen
Wissens um das Wesen von S. pyogenes-assoziierten Erkrankungen
sind adäquate Interventionen und Screeningtests während
solcher Ausbrüche an Kinderbetreuungseinrichtungen in Mitteleuropa
derzeit nicht etabliert [12, 13]. Die Gelegenheit wurde zudem
genützt, um den Genotyp des auslösenden Stammes und
seine Häufigkeit in Bayern zu untersuchen.
|
Material
und Methoden Bakterienstämme
In einem
unterfränkischen Kindergarten (Bayern, Deutschland) wurden
aus Rachenabstrichen vier S. pyogenes-Isolate während
eines Scharlachausbruchs und ein Isolat von einem Kind zu
Beginn einer GN im November und Dezember 2000 gesammelt.
Darüber
hinaus wurden zwischen Dezember 1999 und Dezember 2000 78
S. pyogenes-Isolate in 17 Gemeinden in verschiedenen
Teilen Bayerns aus Rachenabstrichen von Patienten mit den
Symptomen einer persistierenden Tonsillopharyngitis und positivem
Antigen-Schnelltest (Plus Strep A, Abbott, IL, USA) gewonnen,
bevor sie eine antimikrobielle Chemotherapie erhielten.
S.
pyogenes wurde mit einem Partikelagglutinationstest (Phadebact,
Boule Diagnostics AB, Hudinge, Schweden) identifiziert. Isolate,
die während des Scharlachausbruchs in dem Kindergarten
gesammelt worden waren, wurden zusätzlich mit dem API
Strep 20 kit (BioMérieux, Marcy l’Etoile, Frankreich)
analysiert. Die Stämme wurden bis zur weiteren Analyse
auf –180°C gelagert.
Klinische Daten
Informationen
über den Scharlachausbruch und die klinischen Befunde
während der Episoden von GN wurden von einem örtlichen
Kinderarzt gesammelt.
Resistenzbestimmung
Die Isolate
wurden mit der Mikrodilutionsmethode auf ihre Empfindlichkeit
gegen 16 Standardantibiotika getestet wie zuvor beschrieben
[11].
emm-Typisierung
Um den
emm-Genotyp von S. pyogenes-Stämmen
gemäß der Lancefield-Klassifikation zu bestimmen,
wurden emm-spezifische PCR-Produkte präpariert,
und die 5’ Enden der emm-Gene wurden sequenziert
wie zuvor beschrieben [14]. Die Sequenzierung wurde von VBC-Genomics
am Wiener Biocenter durchgeführt. Zur Sequenzanalyse
wurde die NCBI-BLAST-Datenbank (www.ncbi.nlm.nih.gov/blast/)
herangezogen.
Pulsfeld-Gelelektrophorese
(PFGE)
Über
Nacht gezüchtete Bakterien wurden in Blöcke aus
1%igem „Low-melting-point“ Agarosegel (Boehringer-Mannheim,
Mannheim, Deutschland) eingebettet. Die Zellwände der
eingebetteten Organismen wurden in EC-Lysis-Puffer mit Lysozym
(1 mg/ml), (Boehringer-Mannheim) und Mutanolysin (5 Einheiten/ml),
(Sigma, St. Louis, IL, USA) bei 37°C aufgelöst. Zelluläres
Protein wurde über Nacht durch Inkubation in Proteinase
K-haltigem ESP-Puffer (200 µg/ml) (Boehringer-Mannheim)
bei 50°C verdaut. Zur Spaltung der bakteriellen DNS wurde
Restriktionsendonuklease SmaI (Boehringer-Mannheim)
eingesetzt (10 Einheiten/ml). DNS-Fragmente wurden auf einem
1%igen Amresco III-Agaroselaufgel (Sigma) getrennt. Die Elektrophorese
wurde in einem Pulsfeld mit konstanter Spannung von 6 V/cm
(Pulsdauer linear ansteigend von 5 bis 20s und/oder 30s) bei
8°C in einer Elektrophoresekammer (Gene Navigator multidrive
XL, Pharmacia LKB, Crawley, England) über 20 Stunden
durchgeführt. Die DNS-Bandenprofile wurden mit Ethidiumbromid
gefärbt, fotografiert und mit dem Gel Doc 1000 Dokumentationssystem
(Bio-Rad, Segrate-Milan, Italien) digitalisiert. Die Analyse
der DNS-Fragmentationsprofile erfolgte durch visuelle Inspektion
der fotografischen Register auf Basis der von Tenover et al.
vorgeschlagenen Kriterien [15]. Mittels PFGE klassifizierte
Stämme wurden in der Literatur bisher entweder als „Genotyp“,
„PFGE-Typ“ oder „Pulsotyp“ bezeichnet
[6, 16].
|
Ergebnisse
Ausbruch
Neun
von 45 Kindern in dem unterfränkischen Kindergarten erkrankten
Ende Oktober und November 2000 an Scharlach. Anfang Dezember
2000 entwickelten zwei Knaben (Patient 1 und 2), die in engem
Kontakt zu ihren Klassenkameraden gestanden waren, aber keine
klinischen Symptome von Scharlach oder Pharyngitis entwickelt
hatten, eine akute GN.
Patient
1 (4 Jahre und 6 Monate alt) hatte während der Scharlachepidemie
lediglich diskrete Erkältungszeichen ohne weitere Symptome.
Nach einer Woche entwickelte sich eine GN, die sich in Form
von Hämaturie, Proteinurie und Lidödemen manifestierte.
Der ASO-Serumtiter war mit 486 Einheiten/ml erhöht, Serumkreatinin
und C4 blieben innerhalb der Normbereiche. Serum C3 war mit
50,4 mg/dl (Referenzbereich 80-160mg/dl), bereits initial erniedrigt
und fiel in den folgenden Tagen unter das Detektionslimit. Ein
Rachenabstrich zu Beginn der GN war negativ auf S. pyogenes.
Hämaturie und Proteinurie bildeten sich in den folgenden
18 Tagen zurück.
Patient
2 (3 Jahre und 7 Monate alt) hatte während einiger Tage
subfebrile Temperaturen ohne Symptome einer oberen Atemwegsinfektion.
Dann trat plötzlich Fieber von 40°C auf, und eine GN
mit Hämaturie und Proteinurie wurde diagnostiziert. Die
Ultraschalluntersuchung zeigte eine Vergrößerung
beider Nieren. Serum C3 war mit 40 mg/dl erniedrigt, die Kreatinin-Clearance
blieb im Normbereich. Der ASO-Serumtiter war mit einem Wert
von 136 Einheiten/ml nicht erhöht. Ein Rachenabstrich zu
Beginn der GN war positiv auf S. pyogenes, und es erfolgte
eine Eradikation mit Penicillin G. Im Laufe der nächsten
acht Tage waren die Hämaturie und Proteinurie regredient.
Im
Jänner 2001 und in den folgenden Monaten traten in diesem
Kindergarten keine weiteren Fälle von Scharlach oder GN
auf.
Untersuchung
der Isolate
Spezifische
PCR-Produkte der die M-Proteine kodierenden emm-Gene
wurden gewonnen, um den Genotyp der vier Isolate zu bestimmen,
die während des Ausbruchs von Scharlach und von dem GN-Patienten
isoliert worden waren. Die Analyse der terminalen Sequenz (5´
Ende) zeigte, dass alle untersuchten Isolate den emm12-Genotyp
(Tabelle 1) gemäß der Lancefield-Klassifikation
aufwiesen.
Tabelle
1: Auftreten von Streptococcus pyogenes,
Pulsotyp 1 in Bayern
Quelle
(Rachenabstrich) |
Anzahl
an
Isolaten |
Von
diesen
Pulsotyp 1 |
Von
diesen
emm12 |
Scharlachpatienten
im Kindergarten |
4 |
4 |
4 |
GN-Patient
2
(Kindergarten) |
1 |
1 |
1 |
Tonsillopharyngitis-Patienten
in 17 bayrischen Gemeinden |
78 |
11 |
nd* |
| *nicht
durchgeführt |
. |
. |
. |
|
Zur
Ermittlung der genetischen Verwandtschaft zwischen den verschiedenen
emm12-Typ-Isolaten wurde eine PFGE durchgeführt.
Die gefärbten DNS-Muster aller im Kindergarten gewonnenen
Isolate (Scharlach- und GN-Patienten) waren identisch. Das vorliegende
PFGE-Muster wurde als Pulsotyp 1 bezeichnet. Reihen 1-3 in Abbildung
1 zeigen das charakteristische Muster von Pulsotyp 1.
Abbildung
1: PFGE-Muster von SmaI-behandelter
chromosomaler DNS von Streptococcus pyogenes-Isolaten,
die in einem Pulsfeld über 20 Stunden aufgetrennt
wurden. Reihen 1-3: Pulsotyp 1; Reihe 4: Lambda Ladder
Marker; Reihen 5, 6: andere Pulsotypen. Die Größen
der Marker sind an der linken Seite der Abbildung in Kilobasenpaaren
(kb) angezeigt. 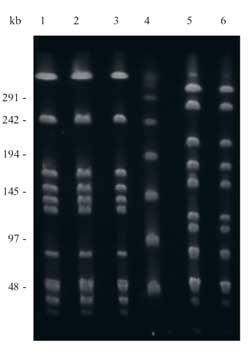
|
Prävalenz von Pulsotyp-1-Stämmen in Bayern
Um
die Häufigkeit von Pulsotyp-1-Stämmen in der regionalen
S. pyogenes-Population zu eruieren, wurde das PFGE-Muster
der Ausbruchsisolate mit jenen von 78 Isolaten aus 17 bayrischen
Gemeinden verglichen. Von diesen Isolaten waren 68 typisierbar.
Zehn Isolate waren nicht typisierbar, weil sie sich mehrfach
als nicht empfindlich gegenüber dem Restriktionsenzym SmaI
erwiesen und daher andere Stämme repräsentierten.
Der Pulsotyp 1 (n = 11) repräsentierte somit 14% aller
analysierten Isolate aus Bayern (Tabelle 1).
Der emm-Typ dieser Isolate wurde nicht zusätzlich
bestimmt, weil bestimmte PFGE-Pulsotypen von S. pyogenes
bekannterweise nicht durch emm-Typisierung unterteilt
werden können [17].
Antimikrobielle
Empfindlichkeit der Pulsotyp-1-Stämme
Die
Pulsotyp-1-Isolate wurden auf ihre Empfindlichkeit gegen Antibiotika
getestet. Alle Isolate waren empfindlich gegen Penicillin (MHK
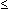 0,12
mg/l); Erythromycin, Clarithromycin, Clindamycin, Amoxicillin
(MHK 0,12
mg/l); Erythromycin, Clarithromycin, Clindamycin, Amoxicillin
(MHK 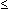 0,25 mg/l); Ceftriaxon, Azithromycin (MHK
0,25 mg/l); Ceftriaxon, Azithromycin (MHK 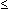 0,5 mg/l); Josamycin (MHK
0,5 mg/l); Josamycin (MHK 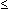 1 mg/l); Levofloxacin, Ciprofloxacin, Tetracyclin, Vancomycin
und Linezolid (MHK
1 mg/l); Levofloxacin, Ciprofloxacin, Tetracyclin, Vancomycin
und Linezolid (MHK 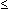 2 mg/l).
2 mg/l).
|
| Diskussion
Subklinische
oder oligosymptomatische S. pyogenes-Infektionen sind
typisch für Kinder vor dem Schulalter [13, 18]. Der Ausbruch
von Scharlach in der Kindergartenklasse, das erniedrigte C3,
der erhöhte ASO-Titer (Patient 1) und die vergrößerten
Nieren (Patient 2) deuteten klar auf eine Poststreptokokken-GN
[5]. Der kurze Zeitraum zwischen dem Auftreten der subfebrilen
Temperatur und der GN in Patient 2 können für den
normalen ASO-Wert in Patient 2 verantwortlich sein. Aufgrund
der raschen klinischen Besserung war ein zweiter ASO-Wert nicht
verfügbar. Wir sind der Ansicht, dass die klinische Verbesserung
in Patient 2 unabhängig von der antibiotischen Therapie
war. Somit scheint die GN in Patient 1 mit großer Sicherheit
Streptokokken-assoziiert zu sein, was höchstwahrscheinlich
auch auf Patient 2 zutrifft. Eine Streptokokken-bedingte Genese
der GN wird auch von früheren Berichten über das nephritogene
Potenzial von emm12 (M12)-Stämmen [3, 5] und von
dem chronologischen Ablauf der Krankheitsereignisse im Kindergarten
gestützt.
Das anhaltende Auftreten von Poststreptokokkenerkrankungen wirft
die Frage auf, ob Ausbrüche von Streptokokkenerkrankungen
in europäischen Kinderbetreuungseinrichtungen angemessen
gemanagt werden, um postinfektiöse Folgeerkrankungen zu
verhindern, oder ob dieses Vorgehen optimiert werden kann. Es
ist allgemein anerkannt, dass Personen, die akute symptomatische
Streptokokkenerkrankungen durchmachen, eine antimikrobielle
Therapie bekommen sollen [19, 20]. Im Gegensatz dazu soll eine
chronische asymptomatische Rachenkolonisation mit S. pyogenes
nicht behandelt werden, da kein erhöhtes Risiko für
Folgeerkrankungen besteht [3]. Es ist jedoch wichtig festzuhalten,
dass akute Racheninfektionen mit S. pyogenes in bis
zu 50% der Fälle in einer subklinischen Form auftreten,
insbesondere bei Kindern vor dem Schulalter. Asymptomatische
Racheninfektionen sind während derartiger Ausbrüche
von großer Bedeutung, weil sie leicht übersehen werden.
Während Ausbrüchen in einem Kindergarten sind daher
insbesondere die Kinder mit einer akuten subklinischen Infektion
dem erhöhten Risiko ausgesetzt, eine Folgeerkrankung wie
rheumatisches Fieber oder GN zu entwickeln [18]. Wie im vorliegenden
Fall werden asymptomatische Kinder in der Regel nicht auf S.pyogenes
getestet und daher während des Ausbruchs in ihrer engen
Umgebung nicht mit Antibiotika behandelt. Es besteht daher eine
Diskrepanz zwischen dem allgemeinen Konsens, alle akut mit S.
pyogenes infizierten Kinder ungeachtet des Vorliegens von
Symptomen zu behandeln, und der verabsäumten Durchführung
von Screeningtests bei allen Kindern an von Ausbrüchen
betroffenen Einrichtungen. Als Konsequenz daraus sollten Streptokokken-Ausbrüche
in Kindergärten mehr Aufmerksamkeit durch die verantwortlichen
Behörden finden.
Tabelle 2 stellt drei Möglichkeiten
für den Umgang mit einer Epidemie in einer Kinderbetreuungseinrichtung
einschließlich der jeweiligen Vor- und Nachteile zur Diskussion.
Der erste Ansatz mit diagnostischen Maßnahmen nur in symptomatischen
Personen ist heutzutage der in Mitteleuropa gebräuchlichste.
Er ignoriert jedoch die hohe Rate an akut infizierten, aber
asymptomatischen Kindern, was das Risiko von Streptokokken-Folgeerkrankungen
für diese unbehandelten Kinder in sich birgt. Diese Maßnahmen
erscheinen daher inadäquat. Strategien 2 und 3 werden derzeit
in Mitteleuropa, von Einzelfällen abgesehen, nicht durchgeführt.
Sie erfordern organisatorische Voraussetzungen und Akzeptanz
seitens der Eltern. Unserer Ansicht nach ist Strategie 2 unter
den gegebenen Umständen am geeignetsten. Wenn mehr als
zwei bis drei Fälle akuter Streptokokken-Infektionen in
einer Kindergruppe auftreten, sollte ein Schnelltest auf S.
pyogenes bei allen Kindern und Betreuern in dem Kindergarten
durchgeführt werden [19]. Positiv getestete Individuen
könnten sofort eine antimikrobielle Therapie bekommen und
dazu angehalten werden, zwei Tage zu Hause zu bleiben. In diese
Maßnahmen sollten auch die Familienmitglieder der Betroffenen
einbezogen werden.
Tabelle
2: Möglichkeiten für die Handhabung
eines akuten Ausbruchs von Streptokokkenpharyngitis oder
Scharlachan einer Kinderbetreuungseinrichtung
| Maßnahmen |
Vorteile |
Nachteile/Risiken |
|
1.
Testen auf S. pyogenesund antimikrobielle Chemotherapie
nur in symptomatischen Individuen und Fernbleiben
von der Einrichtung während der ersten
zwei Behandlungstage |
• Wenig Arbeit und geringe Kosten
• Restriktiver Antibiotika-Einsatz |
• Prolongation des Ausbruchs
• Risiko von postinfektiösen Folgeerkrankungen
in akut infizierten, aber asymptomatischen Kindern
|
|
2.
Testen auf S. pyogenes in allen Individuen,
die die betroffene Einrichtung/Gruppe besuchen;
antimikrobielle Chemotherapie in allen positiv
getesteten Individuen und Fernbleiben von der
Einrichtung während der ersten zwei Behandlungstage |
• Effektive Vorbeugung von postinfektiösen
Folgeerkrankungen
• Restriktiver Antibiotika-Einsatz
• Möglichkeit, die Genese des Ausbruchs
zu untersuchen |
• Arbeit und Kosten für diagnostische
Tests
• Möglichkeit von „Ping-Pong-Infektionen“
– Wiederholung von Maßnahmen könnte
nötig werden |
|
3.
Sofortige antimikrobielle Chemotherapie/ Prophylaxe
für alle Individuen, die die betroffene
Einrichtung/Gruppe besuchen, ohne vorheriges
Testen auf S. pyogenes |
• Keine diagnostischen Tests
• Schnelle Beendigung des Ausbruchs
• Effektive Prävention von post-infektiösen
Folgeerkrankungen |
• Breiter, ungezielter Einsatz von Antibiotika
(Kosten,Compliance, unerwünschte Nebenwirkungen
in Gesunden, kritische öffentliche Meinung,
Förderung von Antibiotika-Resistenzen) |
|
|
Eine
derartige Vorgangsweise wurde schon erprobt und hat sich als
effektiv bei S. pyogenes-Epidemien in Kinderbetreuungseinrichtungen
bewährt [12, 13, 21]. Das dritte Schema (Tabelle
2, letzte Reihe) mit einer sofortigen Behandlung aller Kinder
und des Personals an der betroffenen Einrichtung könnte
die einfachste und effizienteste Intervention zur Verhinderung
von Folgeerkrankungen darstellen. Dennoch kann die unnötige
Verabreichung von Antibiotika an überwiegend gesunde Personen
auch Bedenken auslösen. Unseres Wissens wurde diese Strategie
bisher nicht in einem Kindergarten getestet. Wir regen daher
an, dass erst eine klinische Studie zur Testung von Strategie
3 vorliegen sollte, bevor sie allgemein empfohlen werden kann.
In diesem Kontext erscheint es erwähnenswert, dass vor
allem bei kleineren Kindern die Compliance gegenüber einem
7- bis 10-tägigen oralen Behandlungsschema als kritisch
einzustufen ist. Die Compliance gegenüber jedem Therapieschema
kann gesteigert werden, wenn kürzere, aber effektivere
Antibiotika-Schemata verschrieben werden. Orales und injizierbares
Penicillin ist effektiv und relativ billig und Therapie der
Wahl. Es können natürlich auch andere Substanzen in
Betracht gezogen werden, obwohl deren Fähigkeit, rheumatisches
Fieber oder GN zu verhindern, im Gegensatz zu Penicillin nie
definitiv bewiesen wurde. Bakteriologische Eradikationsraten,
die mit jenen von einer Penicillin-V-Behandlung über 10
Tage (84,1% [22] bzw. 70,9% [23]) vergleichbar sind, wurden
auch für kürzere Behandlungen mit alternativen Medikamenten
berichtet. Nach fünftägiger Behandlung mit Loracarbef
und Cefdinir wurden Eradikationsraten von 81,6% bzw. 89,7% berichtet
[22, 23]. Auch Azithromycin bewirkte eine beachtliche Eradikationsrate
von 94,2%, als es in der Dosierung von 20 mg/kg Körpergewicht
einmal täglich für drei Tage eingenommen wurde [24].
Es gibt also eine Reihe von Antibiotika, die zur Intervention
bei einer S. pyogenes-bedingten Epidemie verwendet
werden können.
Es
wurde in der Literatur berichtet, dass die meisten emm12-Stämme
nicht nephritogen sind und dass unter den emm12-Isolaten
zwei bis sechs verschiedene PFGE-Typen vorliegen [6, 8, 9, 16].
Der Vergleich unserer Ergebnisse mit publizierten Daten zeigt,
dass PFGE-Restriktions-Muster, die mit jenen von Pulsotyp 1
identisch sind, schon zuvor unter verschiedenen emm12-Stämmen
von S. pyogenes gefunden wurden. Dies trifft auf Stämme
zu, die in Belgien [7], Frankreich [16], Brasilien [25], Japan
[17] und den Vereinigten Staaten von Amerika [26] isoliert wurden.
Hierbei entsteht der Eindruck, dass der S. pyogenes-emm12/Pulsotyp-1-Stamm,
obschon global weit verbreitet, in Europa häufiger anzutreffen
ist. Dies ist auch mit der beobachteten Prävalenz von 14%
in Bayern im Einklang. Erwähnenswert ist auch, dass dieser
Stamm bei Streptokokken-Erkrankungen von unterschiedlichem Erscheinungsbild,
wie Rachen- [16], Haut- [25] und invasiven [17] Infektionen,
sowie bei STSS [26] involviert ist. Unseres Wissens war die
Assoziation zwischen diesem charakteristischen PFGE-Subtyp von
emm12-Stämmen und Poststreptokokken-GN aber bislang
noch nicht dokumentiert. Interessanterweise waren in zwei von
drei publizierten Berichten über S. pyogenes-Epidemien
an Kinderbetreuungseinrichtungen emm12-Stämme
als Auslöser beschrieben [12, 27], es scheint sich somit
beim emm12/Pulsotyp-1-Stamm von S. pyogenes
um ein äußerst vielseitiges Pathogen zu handeln.
Schlussfolgerung:
Während Ausbrüchen von Streptokokken-Pharyngitis oder
Scharlach in einem Kindergarten sollten diagnostische Tests
auf S. pyogenes in allen Kindern und Personal durchgeführt
werden, um akut infizierte, aber asymptomatische Kinder zu identifizieren
und vor postinfektiösen Folgeerkrankungen zu schützen.
|
Literatur:
| 1.
Efstratiou A (2000) Group A streptococci in the 1990s. J
Antimicrob Chemother 45:3-12. |
| 2.
Schacht RG, Gluck MC, Gallo GR, Baldwin DS (1976) Progression
to uremia after remission of acute poststreptococcal glomerulonephritis.
N Eng J Med 295: 977-981. |
| 3.
Cunningham MW (2000) Pathogenesis of group A streptococcal
infections. Clin Microbiol Rev 13: 470-511. |
| 4.
Nordstrand A, Norgren M, Ferretti JJ, Holm SE (1998) Streptokinase
as a Mediator of Acute Post-Streptococcal Glomerulonephritis
in an Experimental Mouse Model. Infect Immun 66: 315-321. |
| 5.
Nordstrand A, Norgren M, Holm SE (1999) Pathogenic mechanism
of acute post-streptococcal glomerulonephritis. Scand J
Infect Dis 31: 523-537. |
| 6.
Jasir A, Tanna A, Noorani A, Mirsalehian A, Efstratiou A,
Schalen C (2000) Highrate of tetracycline resistance in
Streptococcus pyogenes in Iran: An epidemiological study.
J Clin Microbiol 38: 2103-2107. |
| 7.
Descheemaeker P, Van Loock F, Hauchecorne M, Vandamme P,
Goossens H (2000) Molecular characterisation of group A
streptococci from invasive and non-invasive disease episodes
in Belgium during 1993-1994. J Med Microbiol 49: 467-471. |
| 8.
Haukness HA, Tanz RR, Thomson RB,Jr., Pierry DK, Kaplan
EL, Beall B, et al.(2002) The heterogeneity of endemic community
pediatric group a streptococcal pharyngeal isolates and
their relationship to invasive isolates. J Infect Dis 185:
915-920. |
| 9.
Dicuonzo G, Gherardi G, Lorino G, Angeletti S, De Cesaris
M, Fiscarelli E, et al. (2001) Group A streptococcal genotypes
from pediatric throat isolates in Rome, Italy.J Clin Microbiol
39: 1687-1690. |
| 10.
Noble RC, Vosti KL (1973) Biologic and immunologic comparison
of nephritogenic and nonnephritogenic strains of group A,
M-type 12 Streptococcus. J Infect Dis 128:761-768. |
| 11.
Sauermann R, Gattringer R, Graninger W, Buxbaum A, Georgopoulos
A (2003) Phenotypes of macrolide resistance of group A streptococci
isolated from outpatients in Bavaria and susceptibility
to 16 antibiotics. J Antimicrob Chemother 51: 53-57. |
| 12.
Falck G, Kjellander J (1992) Outbreak of group A streptococcal
infection in a day-care center. Pediatr Infect Dis J 11:
914-919. |
| 13.
Tindberg Y, Wikman M, Sylvan S(1998) Specimen culture from
all children in a day care center because of an outbreak
of streptococcal infection. Lakartidningen 95:2580-2584.
|
| 14.
Beall B, Facklam R, Hoenes T, Schwartz B (1997) Survey of
emmgene sequences and T-antigen types from systemic Streptococcus
pyogenes infection isolates collected in San Francisco,
California; Atlanta, Georgia; and Connecticut in 1994 and
1995. JClin Microbiol 35: 1231-1235. |
| 15.
Tenover FC, Arbeit RD, Goering RV, Mickelsen PA, Murray
BE, Persing DH, et al. (1995) Interpreting chromosomal DNA
restriction patterns produced by pulsed-field gel electrophoresis:
criteria for bacterial strain typing. Journal of Clinical
Microbiology 33: 2233-2239. |
| 16.
Nguyen L, Levy D, Ferroni A, Gehanno P, Berche P (1997)
Molecular epidemiology of Streptococcus pyogenes in an area
where acute pharyngotonsillitis is endemic. J Clin Microbiol
35: 2111-2114. |
| 17.
Nakashima K, Ichiyama S, Iinuma Y, Hasegawa Y, Ohta M, Ooe
K, et al. (1997) A clinical and bacteriologic investigation
of invasive streptococcal infections in Japan on the basis
of serotypes, toxin production, and genomic DNA fingerprints.
Clin Infect Dis25: 260-266. |
| 18.
Hoeprich P, Jordan M, Ronald A (1994) Infectious Diseases.
5 ed. J.B. Lipppincott Company, Philadelphia. |
| 19.
McIsaac WJ, Kellner JD, Aufricht P, Vanjaka A, Low DE (2004)
Empirical validation of guidelines for the management of
pharyngitis in children and adults. JAMA291: 1587-1595. |
| 20.
Gonzales R, Cooper RJ, Hoffman JR (2004) Strategies to diagnose
and treat group A streptococcal pharyngitis. JAMA292: 167. |
| 21.
Espinosa de los Monteros LE, Bustos IM, Flores LV, Avila-Figueroa
C (2001) Outbreak of scarlet fever caused by an erythromycin-resistant
Streptococcus pyogenes emm22 genotype strain in a day-carecenter.
Pediatr Infect Dis J 20: 807-809. |
| 22.
Adam D, Scholz H, Helmerking M(2001) Short-course therapy
of acute tonsillo-pharyngitis with loracarbef for 5 days
compared to the standard treatment of 10 days penicillin
V and incidence of post-streptococcal sequalae. Monatsschr
Kinderheilkd 149: 1338-1347. |
| 23.
Pichichero ME, Gooch WM (2000) Comparison of cefdinir and
penicillin V in the treatment of pediatric streptococcal
tonsillopharyngitis. Pediatr Infect Dis J 19:171-173. |
| 24.
Cohen R (2004) Defining the optimum treatment regimen for
azithromycin in acute tonsillopharyngitis. Pediatr Infect
Dis J 23:129-134. |
| 25.
de Melo MC, Sa Figueiredo AM, Ferreira-Carvalho BT (2003)
Antimicrobial susceptibility patterns and genomic diversity
in strains of Streptococcus pyogenes isolated in 1978-1997
in different Braziliancities. J Med Microbiol 52: 251-258. |
| 26.
Cockerill FR, 3rd, Thompson RL, Musser JM, Schlievert PM,
Talbot J, Holley KE,et al. (1998) Molecular, serological,
and clinical features of 16 consecutive cases of invasive
streptococcal disease. Southeastern Minnesota Streptococcal
Working Group.Clin Infect Dis 26: 1448-1458. |
| 27.
Smith TD, Wilkinson V, Kaplan EL(1989) Group A streptococcus-associated
upper respiratory tract infections in a day-care center.
Pediatrics 83: 380-384. |
Korrespondierender
Autor:
Univ.-Prof. DDr. Apostolos Georgopoulos
Univ.-Klinik für Innere Medizin I, Klin. Abt.für Infektionen
und Chemotherapie
A-1090 Wien, Währinger Gürtel 18-20
E-Mail: apostolos.georgopoulos@meduniwien.ac.at
|
|
|