Penicillin
– 50 Jahre danach |
| W. Graninger
Univ.-Klinik für Innere Medizin I, Klin. Abt. für
Infektionen und Chemotherapie, Medizinische Universität
Wien
(Leiter: Univ.-Prof. DDr. W. Graninger) |
|
Einleitung
Die
Entdeckung des Penicillins durch den am 6. 8.1881 in Lochfield
geborenen Bakteriologen Fleming beruht eigentlich, wie so oft
bei den großen und wichtigen Entdeckungen, auf einem Zufall.
Fleming, zu diesem Zeitpunkt bereits Professor an der University
of London, beschäftigte sich gerade mit der Erforschung
von Staphylokokken. Diese Erreger führten in der damaligen
Zeit häufig zu Amputationen oder gar zum Tode. Flemings
Staphylokokken-Kulturen wurden häufig durch Schimmelpilze
befallen. Auf einer seiner angelegten Kulturen siedelte sich
ein Schimmelpilz, der als Pinselpilz (Penicillium) bekannt ist,
an. Er bemerkte, dass in der direkten Umgebung des Pilzes keine
weiteren Bakterien wuchsen. Eine ähnliche Entdeckung gab
es bereits im Jahre 1871 durch Joseph Lister. Er stieß
auf das Phänomen, dass Schimmelpilze das Wachstum von Bakterien
auf Käse oder Früchten abschwächen. Er behandelte
eine Krankenschwester mit einem Abszess erfolgreich mit einem
Schimmelpilz. Allerdings maß er diesem Phänomen keine
weitere Bedeutung bei und widmete sich seinen bisherigen Forschungen.
Fleming
züchtete größere Mengen dieses Schimmelpilzes
an und gab ihm den Namen Penicillium notatum (heute
Penicillium chrysogenum). Die gewonnenen Extrakte dieses
Pilzes töteten eine Reihe der gefährlichsten Erreger
ab. Flemings Veröffentlichung fand zunächst keine
Beachtung. Erst 1940 wurde die Bedeutung von Penicillin in Tierexperimenten
klar. |
| Penicilline
Ab
1944 wurde Penicillin in den USA großtechnisch hergestellt.
Die Ausbeute
an Penicillin stieg durch die Verwendung von Maissirup als Substrat
um das 500fache. Nach dem Krieg war die Nachfrage zu groß
– der Schwarzhandel blühte – was in „Der
dritte Mann“ verfilmt wurde. Erst 1957 beschrieben James
Park und Jack Strominger den genauen Wirkmechanismus des Penicillins.
Die Zellwand von Bakterien besteht aus langen Zuckerketten,
die durch Eiweißbrücken vernetzt sind (Peptidoglykane).
Diese Verbrückung wird durch das Enzym Glycopeptid-Transpeptidase
katalysiert, das durch Penicillin blockiert wird.
Penicillin G (Abbildung 1) muss injiziert
werden – durch die mangelnde Säurestabilität
ist eine orale Gabe wirkungslos. Phenoxymethylpenicillin oder
Penicillin V wurde als österreichische Pionierleistung
von Brandl, Margreiter und Spitzy entwickelt, ist säurestabil
und kann in Tablettenform eingenommen werden. Bis heute ist
Pen V Mittel der Wahl bei Streptokokkeninfektionen.
Abbildung 1: Strukturformel
Penicillin
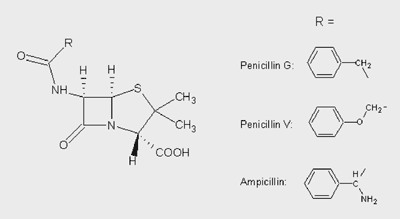
|
Das recht kleine Wirkungsspektrum von Penicillin G veranlasste
die Suche nach Derivaten, die gegen eine größere
Zahl von Infektionen wirksam sein sollten. Der erste Schritt
war die Entwicklung von Ampicillin, das eine gute Wirksamkeit
gegen Gram-positive und Gram-negative Erreger aufweist und relativ
preiswert zur Verfügung steht. Ein weiter Fortschritt war
Flucloxacillin, das gegen ß-Laktamasen von Staphylokokken
resistent ist und deshalb bei Staphylokokkeninfektionen eingesetzt
werden kann. Die Entwicklung der Penicilline gipfelte in der
Synthese von Acylureidopenicillinen wie Azlocillin, Mezlocillin
und Piperacillin. Endlich waren auch Enterobakterien und Pseudomonas
aeruginosa mit Penicillinen behandelbar.
Zahlreiche
klinisch vorkommende Bakterien wurden jedoch gegen Penicillin
resistent, was dazu führte, dass ständig neue ß-Laktam-Antibiotika
entwickelt werden mussten. Die Forschung verlagerte sich in
der Folge auf die Klassen der Cephalosporine und Peneme. Präparate
wie Penicillin G, Ampicillin und Piperacillin sind in vielen
Ländern (wie z.B. Penicillin G in den USA, Piperacillin
in Österreich) zu billig und nicht mehr erhältlich.
Der Untergang der Penicilline war schon vorprogrammiert, als
1977 durch Reading und Cole die Clavulansäure das Licht
der Welt erblickte.
|
| Penicilline
und Betalaktamase-Hemmer
Durch die Blockade von Betalaktamasen lässt sich das Wirkungsspektrum
von Penicillin erweitern. Die Achillesferse ist jedoch, dass
es, wie bei jeder Kombinationstherapie, auch hier zu einem stets
wechselnden Mischungsverhältnis der beiden Komponenten
in den Geweben kommt. Die im Handel erhältlichen Mischungsverhältnisse
entsprechen oft nicht den Kriterien der optimalen In vivo-Wirkung.
Die Mischungsverhältnisse sind auch von Land zu Land unterschiedlich,
sodass im Gegensatz zu Monopräparaten eine verbindliche
Therapieempfehlung oft schwierig ist.
Amoxicillin
+ Clavulansäure
Ziel der Entwicklung dieser Kombination war ursprünglich,
die Wirksamkeit von Amoxicillin auf Staphylococcus aureus
zu erweitern.
Die
Clavulansäure wird durch Fermentation von Streptomyces
clavuligerus gewonnen und ähnelt in seiner Struktur
dem Penicillinkern. Die Clavulansäure stellt einen starken
irreversiblen Betalaktamase-Hemmer der Typen II, III, IV und
V dar. Die Kombination mit Clavulansäure macht Amoxicillin
aktiv gegen Betalaktamase-bildende Stämme von Staphylococcus
aureus und epidermidis, Haemophilus influenzae,
E. coli, Proteus mirabilis und Bacteroides
fragilis.
Indikationen
für die Kombination Amoxicillin / Clavulansäure sind
Atemwegsinfektionen wie eine chronische Sinusitis oder Otitis
media oder eine eitrige Bronchitis durch Betalaktamase-bildende
Haemophilus-Stämme. Weitere Einsatzgebiete sind Mischinfektionen
wie Aspirationspneumonie, abdominelle chirurgische Infektionen,
odontogene Infektionen, Aktinomykose oder der diabetische Fuß.
In
bis zu 25% kommen krampfartige Bauchschmerzen und Übelkeit
vor, insbesondere bei Steigerung der oralen Clavulansäure-Dosis
über 250 mg/d. In ihrer Häufigkeit unbekannt sind
Leberschäden und ein cholestatischer Ikterus, der bis zu
6 Wochen nach Beendigung der Therapie auftreten kann. Diese
Leberschädigungen sind im Allgemeinen reversibel, trotzdem
hat gerade die Lebertoxizität zu verschiedenen Mischungsverhältnissen
von Amoxicillin und Clavulansäure auf dem oralen Sektor
geführt. Entgegen allen Beteuerungen von Herstellerseite
wurde in einzelnen Ländern die Amoxicillindosis bis auf
4 g/d erhöht, wobei die Clavulansäuredosis auf 250
mg/d beschränkt blieb. Kontraindikationen für die
Kombination sind die infektiöse Mononukleose und lymphatische
Leukämie, Lebererkrankungen und Infektionen in der Schwangerschaft.
Die maximale Dosierung ist intravenös 6,6 g pro Tag.
Sulbactam ist ein Penicillansäuresulfon. Es hemmt die Betalaktamasen
der Typen II, III, IV, V. Es liegt sowohl oral wie auch parenteral
in einer fixen Kombination von 1 zu 2 vor, z. B. 0,5 g Sulbactam
+ 1 g Ampicillin. Auch hier ist die Verschiebung des Mischungsverhältnisses
bei der Komponenten in tiefen Kompartimenten unbekannt. Sulbactam
kann auch frei mit anderen Betalaktamen kombiniert werden, wie
z. B. Penicillin G, Mezlocillin, Piperacillin und auch Cephalosporinen.
Diese freien Kombinationen sind in klinischen Studien wenig
untersucht, insbesondere würde man auf Grund mikrobiologischer
Untersuchungen jeweils eine Kombination von 2 zu 1 erwarten.
Bei der in Deutschland gängigen Kombination von Piperacillin
+ Sulbactam als Alternative zu Piperacillin/Tazobactam ist dieses
Mischungsverhältnis von 2 zu 1 jedoch nicht üblich.
Von mikrobiologischer Seite würde man ein Aufheulen erwarten,
es gibt aber keine Kommentare. Sinnvoll wäre eventuell
die Kombination Penicillin G und Sulbactam bei z. B. Haut- und
Weichteilinfektionen;
auch hier gibt es keine relevanten klinischen Untersuchungen.
Die orale Form (Sultamicillin) ist mit der Empfehlung von 750
mg/d deutlich unterdosiert.
Das
Indikationsspektrum von Ampicillin/Sulbactam ist ident mit dem
von Amoxicillin/Clavulansäure. Übelkeit und Erbrechen
sowie Durchfälle treten in deutlich geringerem Ausmaß
auf. Auch hier können selten cholestatische Hepatitiden
auftreten. Kontraindikationen sind wieder auf Grund der Ampicillinkomponente
die infektiöse Mononukleose und lymphatische Leukämie
sowie eine Penicillinunverträglichkeit.
Penicillin
und Clavulansäure bzw. Sulbactam
Obwohl die Kombination durchaus Sinn machen würde, sind
fixe Kombinationen nicht auf dem Markt. Die freie Kombination
Penicillin G und Sulbactam, z. B. 3 g Penicillin und 1,5 g Sulbactam
2 - 3-mal täglich wird von manchen Dermatologen beim Erysipel
verwendet.
Tazobactam
ist eine Weiterentwicklung des Sulbactams. Ebenso wie Sulbactam
wirkt Tazobactam selbst nicht antibakteriell. Der wesentliche
Unterschied gegenüber Ampicillin/Sulbactam ist die Aktivität
gegen Pseudomonas aeruginosa. Piperacillin-resistente
Stämme von Pseudomonas aeruginosa werden durch
Tazobactam aber nicht beeinflusst. Die Pharmakokinetik von Piperacillin
unterscheidet sich bei Einzelgabe nicht von der bei kombinierter
Gabe mit Tazobactam. Nebenwirkungen von Tazobactam sind selten,
die Verträglichkeit auch hoher Dosen ist gut. Das Spektrum
von Piperacillin/Tazobactam ist das breiteste unter den Penicillinen
(Tabelle 1).
Tabelle 1: Erfasstes In
vitro-Erregerspektrum
| Ampicillin |
Amox./Clav. |
Pipera./Tazo. |
| Borrelien
Clostridien
E. faecalis
Gonokokken
H. influenzae
Listerien
M. catarrhalis
Meningokokken
Pneumokokken
Streptokokken
Anaerobier
Bordetella pertussis
Proteus mirabilis
Salmonellen
Shigella sp. |
|
E. coli
|
|
Staphylokokken
Streptokokken
E. coli
H. influenzae
Pneumokokken
Anaerobier
Borrelien
P. mirabilis
E. faecalis
Gonokokken
Listerien
M. catarrhalis
Meningokokken
P. mirabilis
Proteus vulgaris |
Bordetella pertussis
Salmonellen
Shigella sp. |
Proteus vulgaris
Providencia
Morganella
|
|
Staphylokokken
Streptokokken
E. coli
H. influenzae
Pneumokokken
Anaerobier
Borrelien
P. mirabilis
E. faecalis
Gonokokken
Listerien
M. catarrhalis
Meningokokken
P. mirabilis
Proteus vulgaris |
Bordetella pertussis
Salmonellen
Shigella sp. |
Proteus vulgaris
Providencia
Morganella
Pseudomonas aeruginosa |
|
|
Als
Indikationen ergeben sich Infektionen, bei denen Pseudomonas
aeruginosa eine potenzielle Rolle haben könnte, wie
z. B. der granulozytopenische Patient, der Verbrennungspatient
und Patienten mit intraabdominellen Infektionen. Die Dosierung
ist mit 3
x 4,5 bis 4 x 4,5 g deutlich höher als die der anderen
Betalaktamasekombinationen, was seinen Grund in der hohen MHK
von Pseudomonas aeruginosa hat. Theoretisch könnten
Infektionen, bei denen nicht mit Pseudomonas aeruginosa
zu rechnen ist, mit niedrigeren Dosen wie bei denen mit Amoxicillin/Clavulansäure
bzw. Ampicillin/Sulbactam behandelt werden. Piperacillin/Tazobactam
ist unter den gesamten IV-Kombinationen die in klinischen Studien
am besten untersuchte Substanzgruppe. Ein wesentlicher Teil
der positiven Einschätzung ist die hohe Dosierungsmöglichkeit.
Zusammenfassend sind alle Kombinationen von Penicillinen mit
Betalaktamase-Hemmern als notwendiges Übel zu betrachten
bzw. als Verlegenheitslösungen. Positiv ist jedoch bei
allen
Kombinationen die Wirksamkeit gegen Enterokokken zu sehen. Die
große therapeutische Breite der Penicilline wird durch
die kleine therapeutische Breite der Betalaktamase-Hemmer teilweise
wieder aufgehoben. Bis heute liegen keine pharmakokinetisch-pharmakodynamischen
Untersuchungen über die betreffenden Kombinationspartner
im Gewebe vor.
Wo liegt nun der wahre Wert der Penicillin-Betalaktamase-Inhibitor-Kombinationen?
Sinnigerweise wurde der erste Patient mit einem Vancomycin-unempfindlichem
MRSA durch die Kombination Ampicillin-Sulbactam geheilt. Ein
Aspekt, der derzeit die Welt der Antibiosophen bewegt, ist die
erhöhte Inzidenz von ESBL-bildenden Gram-negativen Keimen.
Hier hat sich gezeigt, dass durch Reduktion
des Verbrauches von Cephalosporinen und einen kompensatorisch
gesteigerten Verbrauch von Penicillin-Betalaktamase-Inhibitor-Kombinationen
die Inzidenz von ESBL-bildenden Bakterien signifikant gesenkt
werden konnte. Durch den vermehrten Einsatz von Piperacillin-Tazobactam
im Vergleich zu Ceftazidim und Ceftriaxon fiel in einer Studie
ein Prozentsatz der ESBL-poduzierenden Klebsiellen von 68% auf
37%. Sinnigerweise fiel im selben Zeitraum auch die Resistenzquote
von Pseudomonas aeruginosa gegenüber Piperacillin-Tazobactam
von 11 auf 6%, obwohl diese Kombination vermehrt angewandt wurde.
Der Ersatz von Cefotaxim durch Piperacillin-Tazobactam als Routineantibiotikum
führte in Bezug auf die Clostridium difficile-assoziierte
Enterocolitis zu einer 10-fachen Senkung. Interessant ist auch
eine Studie in Bezug auf Vancomycin-resistente Enterokokken,
in der Ceftazidim durch Piperacillin-Tazobactam ersetzt wurde.
Es sank die Kolonisationsrate mit VRE von 57% auf 8%, als Ceftazidim
wieder verwendet wurde, stieg die Kolonisationsrate mit VRE
erneut auf 36%. Diese drei Studien unterstreichen die Aktualität,
zumindest der Kombination Piperacillin-Tazobactam. Ein wesentlicher
Punkt ist hier wahrscheinlich die hohe Dosis der Penicilline.
In einer englischen Studie, in der das Empfindlichkeitsspektrum
gegenüber Piperacillin-Tazobactam neun Jahre nach seiner
Einführung untersucht wurde, zeigt, dass es zu keiner Resistenzentwicklung
gegenüber Pseudomonas aerugionsa und Proteus
species kam, wohl aber zu einer Steigerung der Resistenz
bei E. coli von 4 auf 10%, bei Klebsiella von 5 auf
21%.
|
| Unerwünschte
Arzneimittelreaktionen der Penicilline Die
häufigsten Nebenwirkungen der Penicilline sind Überempfindlichkeitsreaktionen
bis hin zum anaphylaktischen Schock und zu anaphylaktoiden
Reaktionen wie Asthma und gastrointestinalen Erscheinungen.
Die Sofortreaktionen sind (bei bis zu 1 Stunde nach Penicillin
G-Gabe) fast immer IgE-vermittelt und äußern sich
als anaphylaktische Reaktion. Der anaphylaktische Schock ist
durch einen plötzlich auftretenden Vasomotorenkollaps mit
Bewusstlosigkeit, Krämpfen und Atemstörungen gekennzeichnet
und erfordert eine rasche intensive Therapie mit Flüssigkeitssubstitution
und Adrenalin. Unter den Spätreaktionen (72 Stunden nach
Penicillin-Gabe) ist das makulopapulöse Exanthem die häufigste
unerwünschte Arzneimittelreaktion. Eine interstitielle
Nephritis, eine hämolytische
Anämie, Neutropenie, Thrombozytopenie und Dermatitis exfoliativa
sind sehr selten. Selten kann es durch Bakteriolyse zu Beginn
einer Therapie bei Syphilis oder Rückfallfieber zur Jarisch-Herxheimer-Reaktion
kommen.
Eine
zufrieden stellende Nachweismethode für das Bestehen einer
Penicillin-Allergie ist nicht bekannt. Der Nachweis spezifischer
IgE im Serum kann auch bei Personen positiv sein, die niemals
allergische Erscheinungen gezeigt haben. Wenn ein Patient angibt,
gegen Penicillin überempfindlich zu sein, oder der Verdacht
auf eine Penicillin-Allergie besteht, kann mit einem Kratz-
oder Intrakutan-Test die
Wahrscheinlichkeit einer IgE-vermittelten Überempfindlichkeit
weitgehend ausgeschlossen werden. Bei negativem Kratz- oder
Intrakutan-Test ist der Expositionsversuch mit oralem Penicillin
gestattet. Die Überempfindlichkeitsreaktionen gegenüber
Penicillinen, die früher sicher durch Unreinheit der Präparate
häufiger waren, waren ein Faktor für die verminderte
Verwendung von Penicillinen. In manchen Ländern waren Penicilline,
besonders Depot-Penicilline, nicht erhältlich, da man dort
die Angst vor anaphylaktoiden Reaktionen übertrieben hatte.
Die Penicillin-Allergie ist jedoch weit seltener als angenommen.
In einer amerikanischen Studie wurden
Daten von 6.000 Patienten analysiert, die bereits einmal mit
allergischen Symptomen auf eine Penicillin-Therapie reagiert
hatten. 48% der Patienten erhielten bei einer später auftretenden
Infektionskrankheit erneut Penicillin. Nur bei 2% traten dabei
allergische Reaktionen auf. Obwohl die therapeutische Breite
der Penicilline enorm ist, können bei Überdosierung
jedoch auch neurotoxische Reaktionen mit Krampfanfällen
auftreten. Die Höchstdosis eines Penicillins wird heute
mit 18 g proTag angegeben.
|
| Verabreichungsmodus
Penicilline
sind zellwandaktive Antibiotika. Die Halbwertszeit ist meist
kurz, 30-60 Minuten. Während Spitzy früher behauptet
hatte, durch eine hochdosierte intermittierende Therapie einen
besseren Heilungserfolg zu erzielen, mehren sich nun Expertenstimmen,
die auf Grund von Mausmodellen die Penicilline als Dauerinfusion
empfehlen. Die Entwicklung von Depotpräparaten von Pen
G zur Behandlung von Gonorrhö und Syphilis hat dieser Therapie
entsprochen. In USA werden Penicilline auch heute noch alle
4 Stunden verabreicht und kommen dadurch der kontinuierlichen
Gabe näher. |
| Penicillin
G + V, Ampicillin, Piperacillinund Flucloxacillin –heute
noch aktuell? Trotz
der Entwicklung der Betalaktamaseinhibitoren, der Cephalosporine,
Monobactame und Peneme haben die Penicilline auch heute noch
einen unbestrittenen Platz in der Therapie von Infektionen.
Bei Infektionen durch Streptokokken, Meningokokken, Borrelien
und Treponemen gibt es bis dato kein besseres Antibiotikum als
Penicillin G. Während bei Infektionen durch Pneumokokken
heute der Einsatz von Penicillin G widersprüchlich diskutiert
wird, sind bei der Behandlung des Erysipels Penicilline Mittel
der Wahl, wie aus einer Umfrage an deutschen und österreichischen
Kliniken hervorgeht. (Tabelle 2) Die Behandlung
von Tetanus, Gasbrand und Endokarditits ist ohne Penicillin
undenkbar. Das rheumatische Fieber ist zum Teil durch die oft
nicht gezielte Therapie der Angina mit Penicillin V ausgerottet
worden. Bei Lues ist nach wie vor das Depotpenicillin Mittel
der Wahl. Flucloxacillin ist bei „normalen“ Stämmen
von Staphylococcus aureus das Antibiotikum des Wissenden.
Ampicillin und Amoxicillin sind bei Enterokokken- und Listerieninfektion
nach wie vor die Antibiotika der ersten Wahl. Piperacillin und
Azlocillin sind als „Pseudomonas-Penicilline“ zu
Unrecht aus der kommerziellen Welt der Antibiotika verschwunden.
Überlebt haben die Amino- und Acylureidopenicilline in
Kombinationspräparaten mit Betalaktamase-Hemmern, hier
gehören sie zu den am häufigst verwendeten Antibiotika.
Penicilline sind nicht tot – sie werden auch in Zukunft
unverzichtbare Antibiotika sein.
Tabelle
2: Dosierung und Häufigkeit der Anwendung
(%) der bei der Akuttherapie des Erysipels eingesetzten
„first line“-Antibiotika (Brennecke, JDDG
4, 2005)
| Antibiotikum |
Dosierung |
Gesichtserysipel |
Unterschenkelerysipel |
| Penicillin
oral |
1
- 2 Mio. I. E./d in einer Einzeldosis
3 - 6 Mio. I. E./d in 2 - 3 Einzeldosen |
1,4%
4,1% |
-
8,2% |
| Penicillin
i.m. |
2
- 3 Mio. I. E./d in 1 - 2 Einzeldosen |
- |
2,7% |
| Penicillin
i.v. |
15
- 30 Mio. I. E./d in 3 - 4 Einzeldosen
andere Dosierung |
64%
12% |
55%
12% |
| Flucloxacillin
i.v. |
3
x 1 - 2 g/d |
6,9% |
6,9% |
Amoxicillin-
Clavulansäure i.v. |
3 x 2,2 g/d |
6,9%
|
6,9%
|
Amoxicillin-
Clavulansäure oral |
3 x 1 g/d |
-
|
1,4%
|
Ampicillin
i.v.
(+ Sulbactam) |
3 x 1 - 2 g/d (je 1 g) |
1,4%
|
1,4%
|
Cephalosporine
oral
Cefuroxim
Cefalexin |
2 x 3 x 0,5 g/d
3 x 1 g/d |
1,4%
-
|
1,4%
1,4%
|
Cephalosporine
i.v.ges.
Cefazolin
Cefotiam
Cefuroxim
Cefotaxim |
3 x 2 g/d
2 - 3 x 2 g/d
0,5 - 1,5 g/d in 2 - 3 Einzeldosen
3 x 2 g/d |
13,7%
1,4%
2,7%
5,5%
1,4% |
16,4%
2,7%
2,7%
4,1%
1,4% |
| Clindamycin
i.v. |
3
x 600 mg/d |
1,4% |
- |
|
|
Anschrift
des Verfassers:
Univ.-Prof. DDr. Wolfgang Graninger
Univ.-Klinik für Innere Medizin I,
Klin. Abt. für Infektionen und Chemotherapie
A-1090 Wien, Währinger Gürtel 18-20
E-Mail:wolfgang.graninger@meduniwien.ac.at
|
|
|